Questões de Vestibular
Sobre soluções e substâncias inorgânicas em química
Foram encontradas 980 questões
Assinale a opção correta no item que é do tipo C.
Conforme a classificação de força de um oxiácido, o H3AsO4 e o H3AsO3 são, respectivamente,
B moderado e fraco.
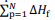 representa o somatório das
entalpias-padrão de formação dos produtos e
representa o somatório das
entalpias-padrão de formação dos produtos e 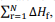 o
somatório das entalpias-padrão de formação dos reagentes.
o
somatório das entalpias-padrão de formação dos reagentes.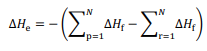
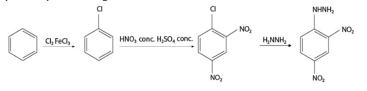
A partir dessas informações e considerando que o volume molar de um gás ideal nas CNTP seja 22,4 L e que todos os gases se comportem de forma ideal, julgue o item que se segue.
Considerando-se que uma solução aquosa tenha sido preparada dissolvendo-se 246 g de nitrato de ureia (CH5N3O4) em 1 kg de acetonitrila (C2H3N) e sabendo-se que a pressão de vapor da acetonitrila, a 27 °C, é igual a 100 mmHg, é correto deduzir que a pressão máxima da solução preparada à mesma temperatura será inferior a 93 mmHg.
Dado: massa molar do HCl = 36,5 g/mol.
H2PO3F(aq) + 2 NaOH(aq) → Na2PO3F(aq) + 2 H2O(l)
Adicionou-se uma solução de NaOH 0,14 mol L-1 ao ácido até ser obtido 0,28 mol de Na2PO3F. Qual foi o volume da solução de NaOH adicionado?

A partir dessas informações, calcule a pureza da amostra de prata recebida pelo laboratório.

Considerando a mistura hipotética de duas soluções de ácido clorídrico (HCl) com volumes de 100 mL e 50 mL, como a mostrada na imagem, a solução final produzida pela mistura dessas duas soluções de “ácido forte” terá pH igual a

A partir desses dados, qual a massa, em miligramas, de AAS presente no comprimido?

DADOS QUE PODEM SER USADOS

DADOS QUE PODEM SER USADOS

Os compostos: NaHCO3, Aℓ(OH)3 e Mg(OH)2 são chamados de antiácidos, porque normalmente são usados para neutralizar o excesso de ácido no estômago (pH entre 0,4 e 1,3). A equação química correta da atuação do antiácido na neutralização é:
Uma solução de NaOH apresenta pressão de vapor superior à da água pura na mesma temperatura.
Sabendo-se que a solubilidade do SO2 em água é de 228 g/L a 20 °C, ainda que todo o SO2 atmosférico seja convertido em H2SO4 por meio das reações apresentadas no texto, a concentração de H2SO4 na água da chuva jamais superará o valor de 3,0 mol/L.
O H2SO4 é capaz de diminuir o pH da água da chuva porque reage com a água, em uma reação chamada hidrólise, que gera o íon hidrônio (H3O+ ) em solução aquosa; essa reação está corretamente descrita na equação a seguir, em que o H2SO4 atua como um ácido de Brønsted-Lowry e a água, como uma base de Brønsted-Lowry.
H2SO4 (aq) + H2O (l) → H3O+ (aq) + HSO4 − (aq)

Uma amostra de 2 mL da água de um rio foi misturada com 8 mL de água pura (destilada) de modo a produzir 10 mL de solução. Essa solução foi submetida ao teste com azul de molibdênio que forneceu o resultado de intensidade de cor igual a 3 unidades arbitrárias. O valor de concentração de fosfato na água desse rio é mais próximo de: