Questões de Vestibular
Comentadas sobre substâncias e suas propriedades em química
Foram encontradas 173 questões
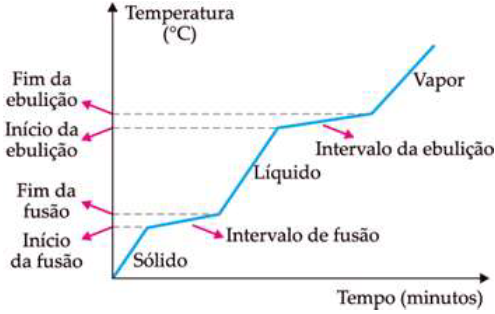
O gráfico indica a mudança de estado físico, por alteração na temperatura, de uma liga metálica de ouro/cobre. A análise gráfica permite concluir que

Cientistas descobriram que a cloração da água para desinfecção produz compostos halogenados secundários, como triclorometano e tribromometano, apresentados na tabela, dentre outras substâncias químicas halogenadas classificadas como carcinogênicas. A recomendação da Organização Mundial da Saúde, OMS, é reduzir a quantidade do cloro adicionada à água e monitorar a concentração dos compostos halogenados para que estejam dentro dos limites estabelecidos.
Com base nas informações e nos dados fornecidos na tabela associados aos conhecimentos sobre a relação entre as estruturas
e propriedades dos compostos moleculares, é correto afirmar:
Leia o texto para responder à questão.
Lâmpadas sem mercúrio
Agora que os LEDs estão jogando para escanteio as lâmpadas fluorescentes compactas e seu conteúdo pouco amigável ao meio ambiente, as preocupações voltam-se para as lâmpadas ultravioletas, que também contêm o tóxico mercúrio.
Embora seja importante proteger-nos de muita exposição à radiação UV do Sol, a luz ultravioleta também tem propriedades muito úteis. Isso se aplica à luz UV com comprimentos de onda curtos, de 100 a 280 nanômetros, chamada luz UVC, que é especialmente útil por sua capacidade de destruir bactérias e vírus.
Para eliminar a necessidade do mercúrio para geração da luz UVC, Ida Hoiaas, da Universidade Norueguesa de Ciência e Tecnologia, montou um diodo pelo seguinte procedimento: inicialmente, depositou uma camada de grafeno (uma variedade cristalina do carbono) sobre uma placa de vidro. Sobre o grafeno, dispôs nanofios de um semicondutor chamado nitreto de gálio-alumínio (AlGaN). Quando o diodo é energizado, os nanofios emitem luz UV, que brilha através do grafeno e do vidro.
(www.inovacaotecnologica.com.br. Adaptado.)

Analise as estruturas das clorofilas a e b.
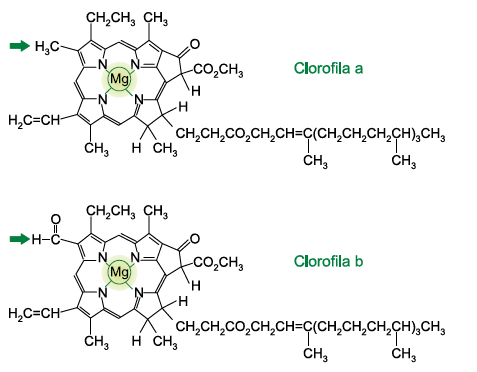
(www.infoescola.com)
As clorofilas a e b estão presentes na estrutura celular denominada __________, sendo que a clorofila ___________é a principal responsável pelo processo de fotossíntese. Nas duas clorofilas, o elemento magnésio encontra-se sob a forma de íons com número de carga _________ . A diferença entre as duas estruturas é a presença, na clorofila b, de um grupo da função orgânica ___________, em vez de um dos grupos metil da clorofila a.
As lacunas do texto são preenchidas, respectivamente, por:
Figura - Esquema da transformação química da matéria.
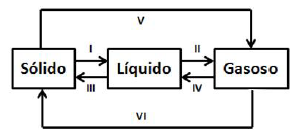 (Fonte: O autor.)
(Fonte: O autor.) Considere os pontos I, II, III, IV, V e VI mostrados na Figura e assinale a alternativa correta em relação ao processo de mudança de fase da matéria.
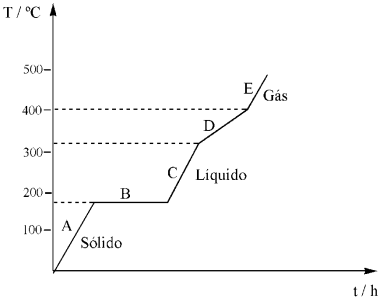
A solda macia (ou solda branca) é uma solda comum à base de uma liga de estanho e chumbo em variadas proporções. Na eletroeletrônica, as soldas são mais usadas em forma de fios, com a liga estanho/chumbo de proporção 60/40, a qual possui ponto de fusão igual a 183 °C. Analisando o gráfico abaixo, que mostra o comportamento térmico dessa solda, assinale a afirmativa CORRETA:

Considerando a sequência de fenômenos sobre a água representados nos quadrinhos, é CORRETO afirmar:




Leia o texto para responder a questão.
Em seu livro Tratado Elementar de Química, publicado em 1789, Antonie Lavoisier estabeleceu uma nova nomenclatura para diversas substâncias químicas. Alguns exemplos, extraídos desse livro, são dados no quadro.
Nome antigo Nome proposto por Lavoisier Nome atual
ar vital oxigênio oxigênio
ar inflamável hidrogênio hidrogênio
ar fixo ácido carbônico dióxido de carbono
ácido vitriólico ácido sulfúrico ácido sulfúrico
vitríolo azul; vitríolo de cobre sulfato de cobre sulfato de cobre (II)
ácido marinho ácido muriático ácido clorídrico
sal marinho muriato de soda cloreto de sódio
soda aerada; soda efervescente carbonato de soda carbonato de sódio
Leia o texto para responder à questão.
“Houston, we have a problem”. Ao enviar essa mensagem, em 13 de abril de 1970, o comandante da missão espacial Apollo 13 sabia que sua vida e as dos seus dois companheiros estavam por um fio. Um dos tanques de oxigênio (O2 ) tinha acabado de explodir. Apesar do perigo iminente dos astronautas ficarem sem O2 para respirar, a principal preocupação da NASA era evitar que a atmosfera da espaçonave ficasse saturada do gás carbônico (CO2), exalado pela própria equipe. Isso causaria diminuição do pH do sangue da tripulação (acidemia sanguínea), já que o CO2 é um óxido ácido e, em água, ele forma ácido carbônico: CO2 (g) + H2O (l) g → H2CO3 (aq).
A acidemia sanguínea deve ser evitada a qualquer custo. Inicialmente, ela leva a pessoa a ficar desorientada e a desmaiar, podendo evoluir até o coma ou mesmo a morte.
Normalmente, a presença de CO2 na atmosfera da nave não é problema, pois existem recipientes, adaptados à ventilação com hidróxido de lítio (LiOH), uma base capaz de absorver esse gás. Nada quimicamente mais sensato: remover um óxido ácido lançando mão de uma base, através de uma reação de neutralização.

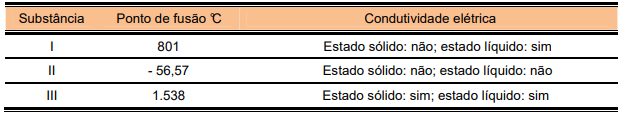
A partir destas informações, pode-se concluir que as substâncias I, II e III, respectivamente, são formadas por ligações:
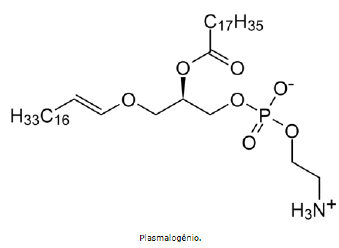
Essas funções bioquímicas estão relacionadas a sua estrutura molecular e possíveis reações e interações químicas. A partir da estrutura apresentada, observamos que
A figura mostra um processo de extração da vanilina a partir de vagens de orquídea espalhadas sobre bandejas perfuradas, em tanques de aço, usando etanol (60% v/v) como solvente. Em geral, a extração dura duas semanas.
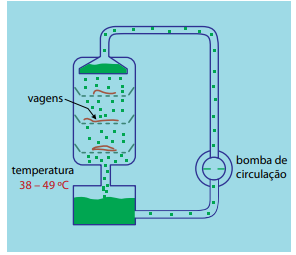
(www.greener-industry.org.uk. Adaptado.)
De acordo com o que mostra a figura, a extração da vanilina a partir de fontes naturais se dá por

Há um tipo de ligação interatômica em que os elétrons das camadas mais externas transitam entre os cátions da rede cristalina. Por essa característica, tal ligação é comparada a um “mar de elétrons”.
“Mar de elétrons” é uma metáfora que se refere ao seguinte tipo de ligação:

Consideram-se arte rupestre as representações feitas sobre rochas pelo homem da pré-história, em que se incluem gravuras e pinturas. Acredita-se que essas pinturas, em que os materiais mais usados são sangue, saliva, argila e excrementos de morcegos (cujo hábitat natural são as cavernas), têm cunho ritualístico.
(www.portaldarte.com.br. Adaptado.)
Todos os materiais utilizados para as pinturas, citados no
texto, são

