Questões de Vestibular
Sobre técnicas de laboratório em química
Foram encontradas 17 questões


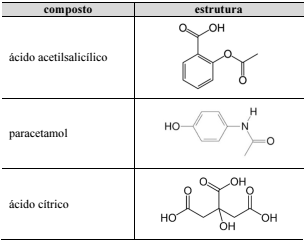
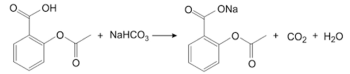
Os compostos orgânicos listados na tabela precedente são amplamente utilizados em medicamentos, entre os quais estão incluídos os efervescentes. Estes resultam da combinação de sólidos misturados e prensados para formar um comprimido contendo o fármaco ácido e um composto básico, como o NaHCO3. Quando o medicamento é colocado na água, a reação entre esses compostos libera CO2, que forma as bolhas na efervescência, como representado para o ácido acetilsalicílico na reação a seguir. Existem, também, vários compostos inorgânicos que são empregados na fabricação de medicamentos, como o FeSO4 e o KMnO4.
Tendo como referência as informações precedentes, julgue o item.
Se os compostos ácido acetilsalicílico e NaHCO3 forem
adequadamente pulverizados e misturados em quantidades
idênticas no comprimido, a mistura formada será
homogênea.
Uma amostra de uma rocha de massa 0.250 g, com baixo teor de Cr, foi submetida à fusão com Na2O2 transformando o cromo em cromato (CrO4 = ). A amostra foi dissolvida em água em ebulição, acidificada e o CrO4 = foi convertido a dicromato (Cr2O7 = ). Na sequência, a amostra foi titulada com 27 mL de solução de Fe2+. Os produtos desta reação foram Fe3+ e Cr3+. Numa padronização paralela, 47 mL de Fe2+ foram usados na redução de 0.1172 g de K2Cr2O7. A reação decorrente foi:
Cr2O7 = + 6Fe2+ + 14H+ → 2Cr3+ + 6Fe3+ + 7H2O.
A massa percentual de Cr na amostra é:
O cátion Ba2+ pode apresentar toxicidade aos humanos, dependendo de sua concentração e forma química. Por exemplo, BaSO4 é pouco tóxico, sendo usado como contraste radiológico, por ser insolúvel em solução aquosa, enquanto BaCO3 e Ba(NO3)2 são muito tóxicos, pois liberam Ba2+ no organismo. Em um laboratório foram feitos dois testes de solubilidade para identificar o conteúdo de três frascos não rotulados que poderiam ser de Ba(NO3)2, BaCO3 ou BaSO4. Os resultados dos dois testes de solubilidade são apresentados a seguir.
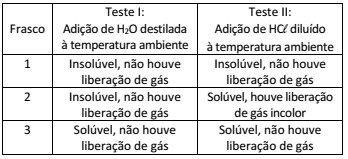
Considerando os ensaios realizados, indique quais são os
compostos contidos nos frascos 1, 2 e 3, respectivamente.
1) Logo após a entrada da água não-tratada nas estações de tratamento, é feita a adição de sulfato de alumínio, para que ocorra a adsorção de partículas sólidas menores presentes na água, num processo chamado de floculação. 2) Para remover as substâncias insolúveis na água, é realizado um procedimento de filtração, em que a água passa por filtros formados por carvão, areia e pedras de diferentes tamanhos. 3) Ao final do processo de tratamento, produtos químicos solúveis, como o hipoclorito de sódio, são adicionados à água tratada para remover e impedir a proliferação de micro-organismos causadores de doenças. Essa água potável final é um exemplo de mistura homogênea.
Está(ão) correta(s) a(s) afirmativa(s):
O grupo G2 acompanhou essa reação ao longo do tempo, porém determinando o volume de dióxido de carbono recolhido (Figura 2)
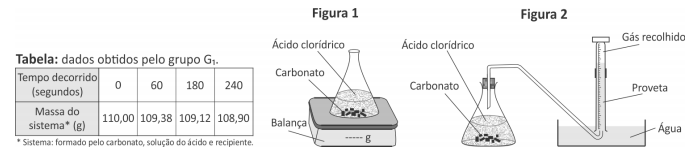
Comparando os dois experimentos, os volumes aproximados de CO2, em litros, recolhidos pelo grupo G2 após 60, 180 e 240 segundos devem ter sido, respectivamente,
DADOS QUE PODEM SER USADOS NESTA PROVA
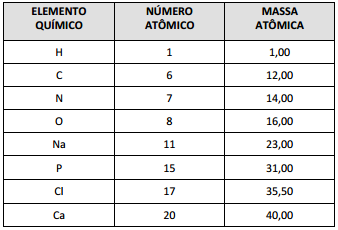

A figura I, acima, apresenta gráficos representativos da
absortividade de alguns gases da atmosfera e da atmosfera como um
todo, enquanto a figura II representa o espectro na faixa de luz
visível. Tendo como base essas figuras e considerando o número de
Avogadro igual a 6 × 1023 e a velocidade da luz igual a 3 × 108 m/s,
julgue os próximos itens.
Sabendo-se que a coloração avermelhada de Marte decorre da presença de grande quantidade de óxido de ferro na superfície do planeta, então o espectro de absorção de luz desse composto pode ser corretamente representado de acordo com a figura abaixo.
Sobre destilação é correto afirmar-se que
Em um experimento, uma pequena amostra de soro sanguíneo foi colocada em um suporte poroso embebido em meio formado por solução salina mantida em pH 6,0. Através desse suporte estabeleceu-se um circuito elétrico, como mostra o esquema abaixo.
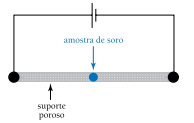
Sabe-se que:
- a carga elétrica de uma proteína depende do pH do meio em que está dissolvida;
- o ponto isoelétrico (pI) de uma proteína corresponde ao pH do meio onde ela é eletricamente neutra;
- quanto mais afastado do pH do meio for o ponto isoelétrico de uma proteína, maior será sua carga elétrica.
A tabela a seguir mostra os valores médios dos pontos isoelétricos e as velocidades de migração de quatro proteínas do soro sanguíneo, para essas condições experimentais:
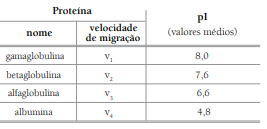
A ordem crescente das velocidades de migração das proteínas citadas é:


