Questões de Vestibular de Química - Transformações Químicas
Foram encontradas 248 questões
ANO INTERNACIONAL DA TABELA PERIÓDICA
Há 150 anos, a primeira versão da tabela periódica foi elaborada pelo cientista Dimitri Mendeleiev. Trata-se de uma das conquistas de maior influência na ciência moderna, que reflete a essência não apenas da química, mas também da física, da biologia e de outras áreas das ciências puras. Como reconhecimento de sua importância, a UNESCO/ONU proclamou 2019 o Ano Internacional da Tabela Periódica.
Na tabela proposta por Mendeleiev em 1869, constavam os 64 elementos químicos conhecidos até então, além de espaços vazios para outros que ainda poderiam ser descobertos. Para esses possíveis novos elementos, ele empregou o prefixo “eca”, que significa “posição imediatamente posterior”. Por exemplo, o ecassilício seria o elemento químico a ocupar a primeira posição em sequência ao silício no seu grupo da tabela periódica.
Em homenagem ao trabalho desenvolvido pelo grande cientista, o elemento químico artificial de número
atômico 101 foi denominado mendelévio.
Com o reflorestamento, é possível minimizar os efeitos do aquecimento global, tendo em vista que uma árvore consegue captar, em média, 15,6 kg do CO2 lançado na atmosfera por ano. Sabe-se que, na combustão completa da gasolina, todos os átomos de carbono são convertidos em moléculas de CO2.
Admitindo que 1 litro de gasolina contém 600 g de isoctano (C8H18) e 200 g de etanol (C2H6O), no período de 1 ano, uma árvore será capaz de captar o CO2 emitido na combustão completa de x litros de gasolina.
O valor de x corresponde, aproximadamente, a:
Os filmes de super-heróis dos quadrinhos se tornaram um fenômeno do cinema nos últimos anos. Um exemplo é o Homem de Ferro, personagem fictício dos quadrinhos publicados pela Marvel Comics. Sua identidade verdadeira é a do empresário e bilionário Tony Stark, que usa armaduras de alta tecnologia no combate ao crime.
Seu traje é feito de titânio (22Ti48), reforçado com fibra de carbono e revestimento cerâmico (usado em coletes à prova de balas e blindagem de carros). Já o capacete é hermeticamente selado, não permitindo, por isso, contaminação por fumaça ou venenos. A viseira é retrátil e um processador ligado à cabeça capta os sinais do cérebro, interpreta as ordens e as repassa para o traje. Instalado no peito do herói, um reator realiza a fusão fria do elemento paládio (46Pd106) para gerar a energia que alimenta as partes-chaves do traje. Além disso, ele também é capaz de disparar raios de energia.

(Fonte: https://www.pinterest.pt/jucianim/desenho/?lp=true Acesso em jan. 2018.)
Em relação aos elementos químicos constituintes do traje do
Homem de Ferro,
As figuras representam dois modelos, 1 e 2, para o átomo de hidrogênio. No modelo 1, o elétron move-se em trajetória espiral, aproximando-se do núcleo atômico e emitindo energia continuamente, com frequência cada vez maior, uma vez que cargas elétricas aceleradas irradiam energia. Esse processo só termina quando o elétron se choca com o núcleo. No modelo 2, o elétron move-se inicialmente em determinada órbita circular estável e em movimento uniforme em relação ao núcleo, sem emitir radiação eletromagnética, apesar de apresentar aceleração centrípeta. Nesse modelo a emissão só ocorre, de forma descontínua, quando o elétron sofre transição de uma órbita mais distante do núcleo para outra mais próxima.
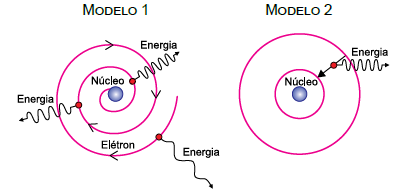
A respeito desses modelos atômicos, pode-se afirmar que
Um laboratório de controle ambiental recebeu para análise uma amostra de gás sem identificação. Após algumas medidas, foram obtidos os seguintes dados:
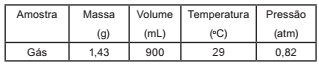
Com base nos valores obtidos, entre os gases indicados
nas opções, conclui-se que a amostra era de:
Dentre os diversos agentes tóxicos, o arsênio é historicamente famoso por se tratar de uma substância muito utilizada na Idade Média para assassinatos com interesses políticos. Podemos até dizer que a morte por arsênio foi a precursora da química forense. Na época, havia uma epidemia desses casos, cuja prevenção era muito difícil, uma vez que óxido de arsênio, As2O3, é um sólido branco, solúvel, sem cheiro e gosto, sendo dificilmente detectado por análises químicas convencionais, o que lhe deu o status de óxido do crime perfeito. Além disso, o óxido de arsênio (III) é um composto muito utilizado na fabricação de vidros e inseticidas. Ele é convertido em ácido arsenioso (H3AsO3 ) em contato com água. Um método para se determinar o teor de arsênio é por meio de oxidação com permanganato de potássio e ácido sulfúrico, conforme equação não balanceada a seguir:
H3AsO3 + KMnO4 + H2SO4 → H3AsO4 + K2SO4 + MnSO4 + H2O
Sabendo que para 2,000 g de amostra foram gastos
10,00 mL de uma solução de KMnO4 0,05 M, em que ocorre a reação acima completa, em meio de ácido sulfúrico, o
percentual de arsênio na amostra é:
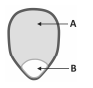
Um grão de milho de pipoca, visto a olho nu, apresenta duas regiões distintas, representadas por A e B na figura. Em A, ocorre o tecido acumulador de amido, usado, pela planta, para nutrir o embrião. Em B, os tecidos vegetais possuem maior teor de água.
Ao ser aquecida, parte da água transforma‐se em vapor, aumentando a pressão interna do grão. Quando a temperatura atinge 177°C, a pressão se torna suficiente para romper o grão, que vira uma pipoca.
Um estudo feito por um grupo de pesquisadores determinou que o interior do grão tem 4,5 mg de água da qual, no momento imediatamente anterior ao seu rompimento, apenas 9% está na fase vapor, atuando como um gás ideal e ocupando 0,1 mL. Dessa forma, foi possível calcular a pressão Pfinal no momento imediatamente anterior ao rompimento do grão.
A associação correta entre região do milho e Pfinal é dada por:
Note e adote:
Constante universal dos gases: R = 0,082 L.atm/(K.mol); K = °C + 273;
Massas molares (g/mol): H = 1; O = 16.
O cinamaldeído é um dos principais compostos que dão o sabor e o aroma da canela. Quando exposto ao ar, oxida conforme a equação balanceada:
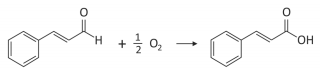
Uma amostra de 19,80 g desse composto puro foi exposta ao ar por 74 dias e depois pesada novamente, sendo que a massa final aumentou em 1,20 g. A porcentagem desse composto que foi oxidada no período foi de
Note e adote:
Massas molares (g/mol):
Cinamaldeído = 132; O2 = 32
Considere que não houve perda de cinamaldeído ou do produto de oxidação por evaporação.
Em seu ciclo, um átomo de carbono pode ser incorporado a diferentes compostos por meio de processos contínuos de decomposição e formação de novas moléculas. Os átomos de carbono deste caderno de prova, por exemplo, serão degradados ao longo do tempo e, posteriormente, incorporados a outros seres vivos.
Considere que, ao se degradarem, os átomos de carbono deste caderno se distribuam igualmente entre os 7,5 bilhões de habitantes do planeta.
Sabendo que o caderno possui 90 g de massa, com 45% de carbono em sua composição, o número de átomos que será incorporado em cada habitante é igual a:
O Halotano, C2HBrClF3 , é um gás não inflamável, não explosivo, e não irritante que é geralmente usado como anestésico, por inalação. Suponha que se faça a mistura de 15.0 g de vapor de Halotano com 23.5 g do gás oxigênio sendo que a pressão total da mistura seja igual a 855 mmHg.
Nas condições apresentadas as pressões parciais do halotano e do oxigênio na mistura serão, respectivamente:
O sulfeto de níquel (II), NiS, ocorre na natureza como um mineral relativamente raro, a millerita. Uma de suas ocorrências é em meteoritos. Para se determinar a quantia de NiS em uma amostra do mineral, ela é tratada com ácido nítrico para liberar o níquel.
NiS(s) + 4HNO3(aq) → Ni(NO3)2(aq) + S(s) + 2NO2(g) + 2H2O(l)
A solução aquosa de Ni(NO3)2 é então tratada com o composto orgânico dimetilglioxima (C4H8N2O2 – DMG) para formar o sólido vermelho Ni(C4 H7N2O2 )2(s) de acordo com a reação:
Ni(NO3 )2(aq) + 2 C4 H8 N2 O2(aq) → Ni(C4 H7 N2 O2 ) 2(s) + 2 HNO3(aq
Se uma amostra de 0.468 g contendo millerita
produz 0.206 g do sólido vermelho Ni(C4
H7
N2
O2
)2(s) , a
porcentagem de NiS na amostra é:
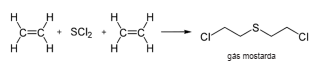
A partir da reação abaixo o volume aproximado, em metros cúbicos de etileno (d=1.18 kg/m3 ), necessário para preparar 2.0 toneladas de gás mostarda é: