Questões de Vestibular de Química - Transformações Químicas
Foram encontradas 248 questões
Dois elementos genéricos X e Y apresentam as seguintes distribuições eletrônicas por camadas: X(2, 8, 8, 1) e Y(2, 8, 18, 6). Considerando-se uma provável ligação química entre esses elementos (X e Y), afirma-se:
I O átomo X ganha 1 elétron e transforma-se em um cátion monovalente.
II A fórmula do composto formado é X2Y.
III A ligação que ocorre entre eles é do tipo iônica.
IV O átomo Y cede 2 elétrons e transforma-se em um ânion bivalente.
São corretas apenas as afirmações:
Recentemente, cientistas conseguiram produzir hidrogênio metálico, comprimindo hidrogênio molecular sob elevada pressão. As propriedades metálicas desse elemento são as mesmas dos demais elementos do grupo 1 da tabela de classificação periódica.
Essa semelhança está relacionada com o subnível mais energético desses elementos, que corresponde a:
Novas tecnologias de embalagens visam a aumentar o prazo de validade dos alimentos, reduzindo sua deterioração e mantendo a qualidade do produto comercializado. Essas embalagens podem ser classificadas em Embalagens de Atmosfera Modificada Tradicionais (MAP) e Embalagens de Atmosfera Modificada em Equilíbrio (EMAP). As MAP são embalagens fechadas que podem utilizar em seu interior tanto gases como He, Ne, Ar e Kr, quanto composições de CO2 e O2 em proporções adequadas. As EMAP também podem utilizar uma atmosfera modificada formada por CO2 e O2 e apresentam microperfurações na sua superfície, conforme ilustrado abaixo.

Adaptado de exclusive.multibriefs.com
Admita que, imediatamente após a colocação do gás argônio em uma embalagem específica, esse gás assume o comportamento de um gás ideal e apresenta as seguintes características:
Pressão = 1 atm
Temperatura = 300 K
Massa = 0,16 g
Nessas condições, o volume, em mililitros, ocupado pelo gás na embalagem é:
Novas tecnologias de embalagens visam a aumentar o prazo de validade dos alimentos, reduzindo sua deterioração e mantendo a qualidade do produto comercializado. Essas embalagens podem ser classificadas em Embalagens de Atmosfera Modificada Tradicionais (MAP) e Embalagens de Atmosfera Modificada em Equilíbrio (EMAP). As MAP são embalagens fechadas que podem utilizar em seu interior tanto gases como He, Ne, Ar e Kr, quanto composições de CO2 e O2 em proporções adequadas. As EMAP também podem utilizar uma atmosfera modificada formada por CO2 e O2 e apresentam microperfurações na sua superfície, conforme ilustrado abaixo.

Adaptado de exclusive.multibriefs.com
Analise o gráfico que mostra a variação da eletronegatividade em função do número atômico.
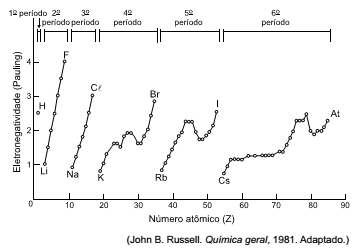
Devem unir-se entre si por ligação iônica os elementos de
números atômicos
Dos extensos efeitos nocivos que a radiação ionizante provoca na matéria viva, afigura-se a geração de radicais livres, que são espécies químicas eletricamente neutras que apresentam um ou mais elétrons desemparelhados na camada de valência. O íon cloreto, por exemplo, que, quantitativamente, constitui o principal ânion do plasma, transforma-se no radical livre Cℓ●, com 7 elétrons na camada de valência, podendo, assim, reagir facilmente com as biomoléculas, alterando o comportamento bioquímico de muitas proteínas solúveis do meio sanguíneo e também os constituintes membranários de células: hemácias, leucócitos, plaquetas.
(José Luiz Signorini e Sérgio Luís Signorini. Atividade física e radicais livres, 1993. Adaptado.)
Ao transformar-se em radical livre, o ânion cloreto
O cloreto de cobalto(II) anidro, CoCℓ2 , é um sal de cor azul, que pode ser utilizado como indicador de umidade, pois torna-se rosa em presença de água. Obtém-se esse sal pelo aquecimento do cloreto de cobalto(II) hexa-hidratado, CoCℓ2 .6H2O, de cor rosa, com liberação de vapor de água.
sal hexa-hidratado (rosa) 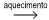 sal anidro (azul) + vapor de água
sal anidro (azul) + vapor de água
A massa de sal anidro obtida pela desidratação completa de 0,1 mol de sal hidratado é, aproximadamente,
O quadro fornece indicações sobre a solubilidade de alguns compostos iônicos inorgânicos em água a 20 ºC.
Em um laboratório, uma solução aquosa obtida a partir da
reação de uma liga metálica com ácido nítrico contém nitrato
de cobre(II) e nitrato de prata. Dessa solução, pretende-se
remover, por precipitação, íons de prata e íons de cobre(II),
separadamente. Para tanto, pode-se adicionar à mistura uma
solução aquosa de
Na formulação da calda bordalesa fornecida pela EMATER, recomenda-se um teste para verificar se a calda ficou ácida: coloca-se uma faca de aço carbono na solução por três minutos. Se a lâmina da faca adquirir uma coloração marrom ao ser retirada da calda, deve-se adicionar mais cal à mistura. Se não ficar marrom, a calda está pronta para o uso. De acordo com esse teste, conclui-se que a cal deve promover
Dados de massas molares em g∙mol-1: sulfato de cobre (II) pentaidratado = 250; hidróxido de cálcio = 74.
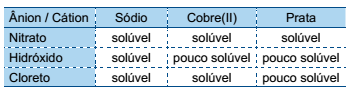
Bicarbonato de sódio sólido aquecido se decompõe, produzindo carbonato de sódio sólido, além de água e dióxido de carbono gasosos. O gráfico mostra os resultados de um experimento em que foram determinadas as massas de carbonato de sódio obtidas pela decomposição de diferentes massas de bicarbonato de sódio.
Os dados do gráfico permitem concluir que as massas de
carbonato de sódio e bicarbonato de sódio nessa reação
estão relacionadas pela equação 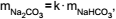 e
que o valor aproximado de k é
e
que o valor aproximado de k é
Considerando a equação de formação da glicose não balanceada C + H2 + O2 → C6H12O6 , atente às seguintes equações:
I. C + O2 → CO2 ΔH = −94,1 kcal
II. H2 + ½ O2 → H2O ΔH = −68,3 kcal
III. C6H12O6 + 6O2 → 6CO2 + 6 H2O ΔH = −673,0 kcal
A massa de glicose formada a partir da reação de 14,4 g de carbono e sua entalpia de formação em kcal/mol serão, respectivamente,
Em um laboratório químico, foi encontrado um frasco de vidro contendo um líquido incolor e que apresentava o seguinte rótulo:
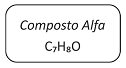
Para identificar a substância contida no frasco, foram feitos os seguintes testes:
I. Dissolveram-se alguns mililitros do líquido do frasco em água, resultando uma solução neutra. A essa solução, adicionaram-se uma gota de ácido e uma pequena quantidade de um forte oxidante. Verificou-se a formação de um composto branco insolúvel em água fria, mas solúvel em água quente. A solução desse composto em água quente apresentou pH = 4.
II. O sólido branco, obtido no teste anterior, foi dissolvido em etanol e a solução foi aquecida na presença de um catalisador. Essa reação produziu benzoato de etila, que é um éster aromático, de fórmula C9H10O2.
Com base nos resultados desses testes, concluiu-se que o
Composto Alfa é:
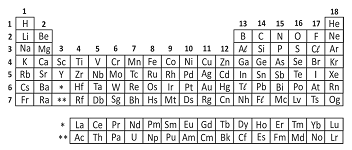
Analise a tabela periódica e as seguintes afirmações a respeito do elemento químico enxofre (S):
I. Tem massa atômica maior do que a do selênio (Se).
II. Pode formar com o hidrogênio um composto molecular de fórmula H2S.
III. A energia necessária para remover um elétron da camada mais externa do enxofre é maior do que para o sódio (Na).
IV. Pode formar com o sódio (Na) um composto iônico de fórmula Na3S.
São corretas apenas as afirmações
Quatro balões esféricos são preenchidos isotermicamente com igual número de mols de um gás ideal. A temperatura do gás é a mesma nos balões, que apresentam as seguintes medidas de raio:
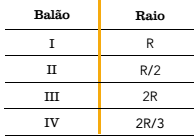
A pressão do gás é maior no balão de número:
A hemoglobina é uma proteína de elevada massa molar, responsável pelo transporte de oxigênio na corrente sanguínea. Esse transporte pode ser representado pela equação química abaixo, em que HB corresponde à hemoglobina.
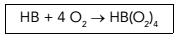
Em um experimento, constatou-se que 1 g de hemoglobina é capaz de transportar 2,24 x 10–4 L de oxigênio molecular com comportamento ideal, nas CNTP.
A massa molar, em g/mol, da hemoglobina utilizada no experimento é igual a:
