Questões de Vestibular Univille 2017 para Vestibular, Segundo Semestre
Foram encontradas 7 questões
Baseado nas informações fornecidas e nos conceitos químicos, analise os itens a seguir.
I Misturando-se 2 mL de uma solução de Codaten® com 5 gotas de KMnO4 (1,0 mol/L) observa-se a mudança da coloração de violeta para castanho.
II Misturando-se separadamente 2 mL de uma solução de Energil C® e 2 mL de uma solução de Tylenol® ,ambas com 5 gotas do regente de Jones, observa-se uma coloração verde em ambas reações.
III As fórmulas do óxido de manganês IV, sulfato de cromo III, cloreto férrico e bicarbonato de sódio são, respectivamente:
MnO2, Cr2(SO4)3, FeCl2 e NaHCO3.
IV Misturando-se 2 mL de uma solução de Aspirina® com 5 gotas de bicarbonato de sódio (1,0 mol/L) observa-se a liberação de um gás.
Assinale a alternativa correta.
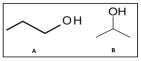
Assinale a alternativa que contém os respectivos compostos orgânicos formados.
A reação (não balanceada) dos íons permanganato com íons iodeto em meio alcalino pode ser representada por:
I-(aq) + MnO4-(aq) + H2O I2(aq) + MnO2(s) + OH-(aq)
Uma vez balanceada, a soma dos menores coeficientes estequiométricos inteiros dos reagentes é:
Para determinar a porcentagem de prata em uma liga metálica, 0,500g dessa liga foi dissolvida em ácido, causando a dissolução da prata na forma de íons Ag+ . Essa dissolução foi diluída em água e adicionado um indicador apropriado para titulação com uma solução de [KSCN] = 0,1 mol/L.
Ag+(aq) + SCN-(aq) → AgSCN(s)
Nessa titulação foram necessários 40 mL da solução de KSCN. A porcentagem em massa de prata nessa liga é: Dados: Ag: 108g/mol.
Sob temperatura de 25ºC foram misturados 500mL de uma solução de hidróxido de sódio 0,1 mol/L com 500mL de uma solução de ácido clorídrico 0,05 mol/L. Assim, analise as afirmações a seguir. Dados: log5 = 0,7
I A mistura terá um pH = 12,4.
II Na mistura terá [OH- ] = 2,5.10-3 mol/L.
III Na mistura terá uma [Na+ ] = 0,05 mol/L.
IV Na mistura terá uma [Cl- ] = 0,05 mol/L.
Está(ão) correta(s) apenas:
Baseado nos conceitos químicos, analise as afirmações a seguir.
I O comprimento da ligação entre o enxofre e o oxigênio no SO3 é menor que a ligação entre enxofre e oxigênio no SO32- .
II O comprimento da ligação entre os átomos de nitrogênio no N2 é maior que a ligação entre os átomos de nitrogênios no N2H4.
III Na mesma concentração, temperatura e pressão o ácido acético é mais forte que o ácido tricloroacético.
Está(ão) correta(s) apenas:
Assinale a alternativa que contém a ordem decrescente da temperatura de ebulição das seguintes espécies químicas:
H2; Ne; CO e NH3.
Dados: H: 1 g/mol; Ne: 20 g/mol; C: 12 g/mol; N: 14 g/mol; O: 16 g/mol.