Questões de Vestibular CESMAC 2015 para Prova Medicina-2016.1- 2° DIA- PROVA TIPO 1
Foram encontradas 60 questões
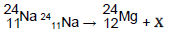
para completar a equação dessa reação nuclear, a espécie X deve ser:
De acordo com os dados fornecidos sobre o Paraquat, determine a sua fórmula mínima e a sua fórmula molecular, respectivamente.
1) O NOX do cobalto é +3, pois tem-se o íon Co3+ .
2) Apresenta ligações iônicas e covalentes coordenadas.
3) O íon nitrato apresenta carga 1−.
Está(ão) correta(s):

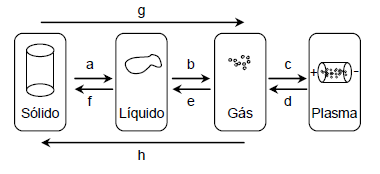 1) As transformações a, b, c e g ocorrem com o
aumento da entropia.
1) As transformações a, b, c e g ocorrem com o
aumento da entropia.
2) As transformações g e h correspondem à sublimação e à condensação, respectivamente.
3) As transformações e e f correspondem à condensação e à solidificação, respectivamente.
Está(ão) correta(s):
Dados: Massas molares em g . mol−1 : H = 1; C = 12; N = 14; O = 16.
Fórmula molecular da creatinina: C4H7N3O
x Au(s) + y NO3− (aq) + w H+ (aq) + z Cl− (aq) → a AuCl4− (aq) + b H2O(l) + d NO(g)
Após balancear a equação acima com os menores números possíveis, correspondentes, a soma dos coeficientes estequiométricos será:
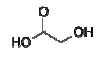 e é produzido pela reação do ácido cloroacético com o
hidróxido de sódio seguida por uma re-acidificação. A
reação pode ser equacionada da seguinte maneira:
e é produzido pela reação do ácido cloroacético com o
hidróxido de sódio seguida por uma re-acidificação. A
reação pode ser equacionada da seguinte maneira:
ClCH2CO2H + NaOH → HOCH2CO2H + NaCl
Desta forma, alguns milhões de quilogramas de ácido glicólico são produzidos anualmente.
Calcule a quantidade de ácido glicólico produzida a partir de 200 g de ácido cloroacético e 70,0 g de hidróxido de sódio. Dados: Massas molares em g . mol−1 : H = 1; C = 12; O = 16; Na = 23; Cl = 35,5.
À partir dessas informações, foram feitas três afirmações:
1) À temperatura ambiente, as moléculas dos componentes da gasolina e as do oxigênio não têm energia suficiente para iniciar a combustão.
2) A reação de combustão entre as moléculas dos componentes da gasolina e as do oxigênio pode ser iniciada na presença de um cigarro aceso, provocando uma explosão.
3) Entre as moléculas dos componentes da gasolina podemos encontrar compostos derivados do benzeno, que são compostos cancerígenos.
Está(ão) correta(s) a(s) afirmativa(s):
H2(l) + ½ O2(l) → H2O(g), ∆H = -242 kJ.mol-1
Levando-se em consideração a aplicação, e que todo o combustível é consumido, qual é a energia (J) liberada para propulsão do ônibus espacial?
2 CrO42-(aq) + H+(aq)
 Cr2O72-(aq) + H2O(l)
Cr2O72-(aq) + H2O(l)
À partir deste equilíbrio, foram feitas três afirmações:
1) Em pH ácido, o equilíbrio será deslocado para a formação do íon dicromato.
2) Em pH básico, o equilíbrio será deslocado para a formação de íon cromato.
3) O equilíbrio químico não é dinâmico, por isso acima de pH 7 deve ocorrer o consumo total de íons dicromato.
Está(ão) correta(s) a(s) afirmativa(s):
C6H12O6(s) + 6 O2 (g) → 6 CO2(g) + 6 H2O(l)
Calcule a entalpia padrão de combustão da glicose sabendo as entalpias padrão de formação:
∆Hf°(C6H12O6,s) = −1.268 kJ∙mol−1 ∆Hf°(CO2,g) = −393,51 kJ∙mol−1 ∆Hf°(H2O,l) = −285,83 kJ∙mol−1
I. Zn(s) + 2OH− (aq) → ZnO(s) + H2O(l) + 2e− , E° = +1,26 V
II. 2MnO2(s) + H2O(l) + 2e− → Mn2O3(s) + 2OH− (aq), E° = +0,26 V
É correto afirmar sobre as pilhas alcalinas:
1) A reação (I) ocorre no ânodo; a reação (II) ocorre no cátodo.
2) A concentração do eletrólito alcalino (KOH) é mantida constante.
3) O potencial de cela (∆E°) desenvolvido através da célula eletroquímica, envolvendo as duas reações (I e II), será de +1,52 V.
Está(ão) correta(s) a(s) afirmativa(s):
1) Na água com gás a velocidade de reação deve ser menor do que em água natural.
2) Em água gelada a velocidade de reação deve ser menor que em água natural.
3) No terceiro dia a vitamina C efervescente se dissolveu mais rápido que nos dias anteriores.
Está(ão) correta(s) apenas:
H2(g) + S(s)
 H2S(g)
H2S(g)
as quantidades de gás hidrogênio e sulfeto de hidrogênio são 0,40 g e 0,47 g, respectivamente, determine a constante de equilíbrio, Kc para a reação em estudo.
Dados: Massas molares em g . mol−1 : H = 1; S = 32.
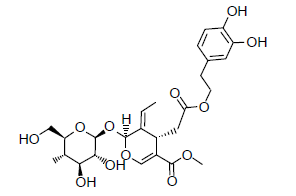
três afirmações foram feitas:
1) Possui os grupos éster, éter e álcool.
2) Possui átomos de carbono com geometria tetraédrica ou trigonal planar.
3) Apresenta isomeria ótica, pois possui carbonos assimétricos (quirais).
Está(ão) correta(s) a(s) afirmativa(s):
Com relação aos polímeros, três afirmações foram feitas:
1) Os polímeros são compostos por monômeros (unidades) que se repetem.
2) As ligações entre os monômeros (unidades) dos polímeros são iônicas.
3) As principais propriedades dos polímeros estão associadas à estrutura do monômero utilizado.
Está(ão) correta(s) a(s) afirmativa(s):