Questões de Vestibular CESMAC 2016 para Prova Medicina- 2017.1- 2° DIA- PROVA TIPO 1
Foram encontradas 20 questões
1) O grafite e o diamante são formas alotrópicas do carbono.
2) O oxigênio molecular (O2) e o ozônio (O3) são formas alotrópicas do oxigênio.
3) A água e a água oxigenada são formas alotrópicas do íon hidróxido.
Está(ão) correta(s) a(s) afirmativa(s):
Com relação a essas descrições, três afirmações foram feitas:
1) Nos átomos ou moléculas, os elétrons podem absorver ou emitir energia, passando de um orbital para outro.
2) A teoria quântica foi fundamental para o desenvolvimento do modelo atômico atual.
3) O modelo atômico de Bohr é o modelo atômico mais atual.
Está(ão) correta(s) a(s) afirmativa(s):
Com relação a essa descrição, três afirmações foram feitas:
1)
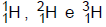 são isótopos do hidrogênio. 2)
são isótopos do hidrogênio. 2) 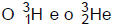 são elementos isóbaros. 3)
são elementos isóbaros. 3) 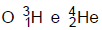 são elementos isótonos.
são elementos isótonos.
Está(ão) correta(s) a(s) afirmativa(s):
Com relação a essa descrição, três afirmações foram feitas:
1) O Li, Na e K fazem parte do grupo dos metais alcalino-terrosos, grupo que apresenta facilidade em perder 1 elétron, formando cátions monovalentes.
2) O Ni, Cu, Fe, Ag, Pb, Au e Zn são chamados de elementos metálicos por possuírem os últimos elétrons localizados em obitais d.
3) O F, Cl, Br e I fazem parte do grupo dos calcogênios, grupo que apresenta facilidade em perder 1 elétron, formando ânions monovalentes.
Está(ão) correta(s) a(s) afirmativa(s):
Com relação a essa descrição, três afirmações foram feitas:
1) A “ligação de hidrogênio” é um tipo de ligação entre o átomo de hidrogênio e átomos de oxigênio ou nitrogênio, e pode ocorrer de forma intermolecular (entre os átomos de diferentes moléculas).
2) As ligações de Van der Waals são ligações mais fortes que as ligações covalentes e ocorrem de forma intramolecular (entre os átomos de uma mesma molécula).
3) Numa ligação covalente ocorre o compartilhamento de elétrons entre dois átomos.
Está(ão) correta(s) a(s) afirmativa(s):
Dados:
Massas molares em g . mol−1: Li = 7; C = 12; O = 16.
Ca3(PO4)2(s) + 3 H2SO4(aq) → 3 CaSO4(s) + 2 H3PO4(aq)
A mistura resultante de CaSO4 e H3PO4 é seca, pulverizada e espalhada pelos campos para plantações, onde o fosfato é dissolvido pelas águas das chuvas. Calcule a quantidade de ácido fosfórico produzida a partir de 1,00 kg de ácido sulfúrico.
Dados: Massas molares em g . mol−1: H = 1; O = 16; P = 31; S = 32.
x NH3(g) + y CuO(s) → t N2(g) + w Cu(s) + z H2O(g)
A soma dos coeficientes estequiométricos, x, y, t, w e z que tornam a equação balanceada é:
C6H12O6(s) → 2 C2H5OH(l) + 2 CO2(g) ∆H°= −74,0 kJ.mol−1
Calcule a quantidade de glicose, em gramas, a ser fermentada para produzir 300 kJ de calor.
Dados: Massas molares em g.mol−1: H = 1; C = 12; O = 16.
C6H12O6(s) + 6 O2(g)
 6 CO2(g) + 6 H2O(l)
6 CO2(g) + 6 H2O(l)
Sabendo os valores de entalpia (∆H = −2.805 kJ.mol−1) e entropia (∆S = 259 J.mol−1.K−1), à temperatura ambiente (25°C = 298 K), determine a energia livre de Gibbs (∆G) para esta reação e indique se a reação é espontânea ou não
CO(g) + 2 H2(g)
 CH3OH(g)
CH3OH(g)
Com relação a esse equilíbrio, três afirmações foram feitas:
1) A formação de metanol é favorecida pela remoção de CO.
2) O aumento da pressão não influencia o equilíbrio.
3) A adição de gás hidrogênio favorece a formação de metanol.
Está(ão) correta(s) a(s) afirmativa(s):
NaHCO3(aq) + HCl(aq) → NaCl(aq) + H2CO3(aq) H2CO3(aq)
 H2O(l) + CO2(g)
H2O(l) + CO2(g)
Com relação às reações acima, três afirmações foram feitas:
1) O NaHCO3 é uma base que reage com HCl para gerar um novo ácido, o ácido carbônico.
2) O aumento da quantidade de H2CO3 no estômago desloca o equilíbrio para a formação de CO2, que explica o alívio e liberação de gás do estômago.
3) Quando tomamos NaHCO3 o pH do estômago aumenta.
Está(ão) correta(s) a(s) afirmativa(s):
8 Cl2(g) + 8 H2S(aq) → S8(s) + 16 HCl(aq)
Analisando a reação redox acima, três afirmações foram feitas:
1) O H2S é o agente oxidante.
2) O NOX (número de oxidação) do cloro varia de zero para -1; portanto, o cloro sofre redução.
3) Cada mol de Cl2 gasoso recebe 2 mol de elétrons.
Está(ão) correta(s) a(s) afirmativa(s):
2 CO + 2 NO
 2 CO2 + N2
2 CO + O2
2 CO2 + N2
2 CO + O2  2 CO2
2 NO2
2 CO2
2 NO2  2 O2 + N2
2 O2 + N2Com relação às equações das reações descritas, analise as afirmações seguintes:
1) Todas as equações envolvem catálise heterogênea.
2) Os catalisadores são consumidos nas reações.
3) Os catalisadores diminuem a energia de ativação das reações, aumentando assim a velocidade.
Está(ão) correta(s) a(s) afirmativa(s):
1) segundo a nomenclatura IUPAC, o nome do ácido caprílico é ácido heptanóico. 2) apresenta uma ligação π. 3) é um ácido carboxílico saturado.
Está(ão) correta(s) a(s) afirmativa(s):
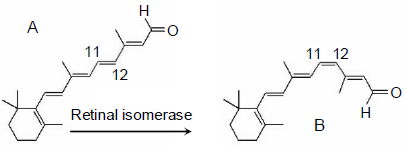
Com relação ao esquema, três afirmações foram feitas:
1) O composto A é o isômero cis do retinol. O composto B é o isômero trans do retinol.
2) No composto A, todas as duplas ligações do retinol estão conjugadas.
3) No composto B, apenas três duplas ligações do retinol estão conjugadas.
Está(ão) correta(s) a(s) afirmativa(s):
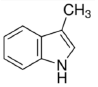
Quais são as funções orgânicas presentes neste composto?