Questões de Vestibular CESMAC 2017 para Prova de Medicina-2017.2- 2° DIA- PROVA TIPO 1
Foram encontradas 20 questões
Com relação à descrição do texto acima, assinale a alternativa correta.
De acordo com as estruturas de Lewis das moléculas descritas abaixo, identifique qual delas está desenhada de forma incorreta.
(Dados: Números atômicos: H = 1, C = 4, N = 5).
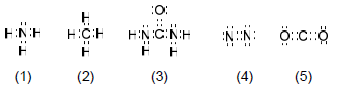
Pequenas quantidades de óxido nítrico (NO) ocorrem naturalmente em nossos corpos, nos quais age como um neurotransmissor, ajuda a dilatar os vasos sanguíneos e participa em outras mudanças psicológicas. Considere a reação de obtenção do óxido nítrico a partir de amônia e oxigênio, como mostra a equação química não-balanceada:
x NH3(g) + y O2(g) → z NO(g) + w H2O(g)
Após balancear a referida equação com os menores
números inteiros possíveis, a soma dos coeficientes
estequiométricos é:
De acordo com a tabela periódica (família dos calcogênios), assinale a alternativa correta.
1) O gás é comprimido (maior pressão) na parte externa da geladeira (compressor), levando à temperatura T1. 2) Após ser comprimido o gás passa por um radiador, onde ocorre troca de calor com o ambiente. Portanto, ao final de certo período, o gás comprimido no radiador passa à temperatura T2. 3) Em uma última etapa, o gás comprimido (temperatura T2) é liberado em um volume maior, em contato com o interior da geladeira, fazendo com que a temperatura passe para T3.
De acordo com a equação dos gases ideais, é correto afirmar que:
Dados: Massas molares em g . mol−1 : H = 1; C = 12; O = 16; S = 32; Na = 23; Au = 197.
As concentrações de Myocrisin nas injeções intramusculares e no soro sanguíneo, em mol.L −1, são, respectivamente:
A Aspirina, o medicamento mais conhecido e consumido no mundo, completou cem anos em 1999. Além de atuar como analgésico, é anti-inflamatório, antipirético e antiplaquetário. Seu princípio ativo é o ácido acetilsalicílico, C9H8O4 sintetizado pela reação do ácido salicílico, C7H6O3, com anidrido acético, C4H6O3 como mostrado pela equação química:
C7H6O3(s) + C4H6O3(l) → C9H8O4(s) + C2H4O2(l)
Calcule a massa de anidrido acético necessária para consumir completamente 2,00 . 102 g ácido salicílico.
Dados: Massas molares em g . mol−1 : H = 1; C = 12; O = 16.
Sabendo que a reação de combustão da glicina é representada pela equação química:
4 C2H5NO2(s) + 9 O2(g) → 8 CO2(g) + 10 H2O(g) + 2 N2(g)
calcule o calor liberado na reação acima, a 298 K, a partir das entalpias-padrão de formação listadas na Tabela 1.
Tabela 1. Entalpias-padrão de formação, ∆Hf°, a 298 K.
Substância C2H5NO2(s) CO2(g) H2O(l)
∆Hf°(kJ/mol) −533,0 −394 −286
Hb(aq) + CO(aq)
 HbCO(aq) ΔG° = −80 kJ.mol -1 Hb(aq) + O2(aq)
HbCO(aq) ΔG° = −80 kJ.mol -1 Hb(aq) + O2(aq) HbO2(aq) ΔG° = −70 kJ.mol -1
HbO2(aq) ΔG° = −70 kJ.mol -1 De acordo com as equações químicas acima, qual é a variação de energia livre para a reação de substituição do CO ligado à hemoglobina (HbCO) pelo O2?
Sabendo que o produto de solubilidade do sulfato de bário, BaSO4, é definido por
BaSO4(s)
 Ba2+(aq) + SO4
2−(aq) Kps = 1,0 . 10−10
Ba2+(aq) + SO4
2−(aq) Kps = 1,0 . 10−10
calcule a solubilidade molar deste sal.
Em razão dos intensos exercícios físicos, os praticantes de esportes de alta performance podem sofrer de “acidose”, cujos sintomas iniciais podem ser: cefaleia (dor de cabeça), sonolência, tremor nos músculos etc. Ao praticar esporte, o organismo libera grandes quantidades de ácido láctico na corrente sanguínea, e o sangue então se torna ácido (pH < 7). Para evitar os efeitos colaterais da acidose, o organismo deve liberar no sangue uma quantidade de base bicarbonato, suficiente para neutralizar esta acidez através do efeito tampão.
Sabendo que o equilíbrio de transferência de prótons do ácido carbônico é:
H2CO3(aq) + H2O(l) HCO3 −
(aq) + H3O
+
(aq)
HCO3 −
(aq) + H3O
+
(aq)
Ka = [HCO3] / [H2CO3] . [H3O+]
e que o pKa do ácido carbônico nas condições
fisiológicas do corpo é 6,1, qual deve ser a proporção
entre as concentrações do íon bicarbonato e do ácido
carbônico [HCO3−]/[H2CO3], para que o pH do sangue
seja mantido em 7,34 (o pH ideal do sangue)?
Com relação aos conceitos sobre ácidos e bases, três afirmações foram feitas:
1) Na reação de dissociação do HCl em água: HCl(g) + H2O(l)
 H3O+(aq) + Cl−
(aq)
a água é considerada uma base de Arrhenius. 2) Na reação da amônia com o HCl:
NH3(aq) + HCl(aq)
H3O+(aq) + Cl−
(aq)
a água é considerada uma base de Arrhenius. 2) Na reação da amônia com o HCl:
NH3(aq) + HCl(aq)  NH4+(aq) + Cl−
(aq)
a amônia é considerada uma base de BronstedLowry.
3) Na reação do BF3 + F−
: BF3 + F− → BF4
− o BF3
é considerado um ácido de Lewis.
NH4+(aq) + Cl−
(aq)
a amônia é considerada uma base de BronstedLowry.
3) Na reação do BF3 + F−
: BF3 + F− → BF4
− o BF3
é considerado um ácido de Lewis.
Está(ão) correta(s) a(s) afirmativa(s):
C6H12O6(s) + 6 O2(g) → 6 CO2(g) + 6 H2O(l) + calor
Quando 1 mol de glicose reage, quantos mols de elétrons são transferidos nesta reação redox?
A pilha seca foi inventada e patenteada em 1866 pelo engenheiro francês Georges Leclanché. A pilha de Leclanché é a precursora das pilhas secas modernas, podendo ser utilizadas em lanternas, rádios portáteis, gravadores, brinquedos etc. As reações que ocorrem na pilha seca são as seguintes:
No cátodo:
2 MnO2(s)+2 NH4 + (aq)+2 e−→ Mn2O3(s)+2 NH3 (aq)+ H2O(l) E° = 0,737 V
No ânodo:
Zn → Zn2+ + 2 e− E° = − 0,763 V
Qual é a máxima variação de potencial (ΔE) obtida nesta pilha?
No corpo humano, o álcool é removido da corrente sanguínea por uma série de reações metabólicas. A primeira reação produz etanal, de acordo com a equação química abaixo:
[O]
CH3CH2OH → CH3CHO
Foi realizado o acompanhamento da variação da concentração de etanol [C2H5OH] no sangue de um indivíduo alcoolizado para determinar a velocidade (v) pela qual o etanol é removido do sangue através das reações que ocorrem no organismo:
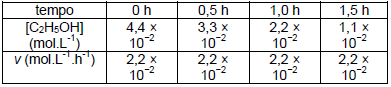
A partir dos dados fornecidos, assinale a alternativa
que contém os dados corretos para a equação da
velocidade da reação, o valor da constante de
velocidade e a ordem da reação.
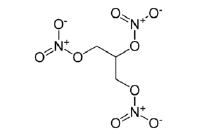 podemos afirmar que a trinitroglicerina:
podemos afirmar que a trinitroglicerina: 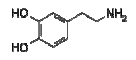 é correto afirmar que:
é correto afirmar que:As reações orgânicas descritas abaixo são exemplos de reações que fazem parte do dia a dia de todos os habitantes do nosso planeta:
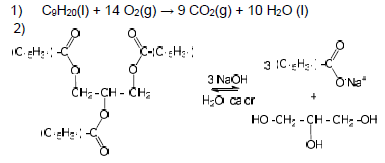
As reações (1) e (2) acima são conhecidas,
respectivamente, como:
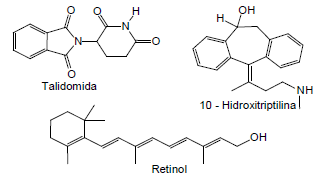 De acordo com a fórmula estrutural dos compostos
apresentados, analise as afirmações seguintes. 1) A talidomida apresenta apenas um carbono com
quatro ligações diferentes e, portanto, é um
composto que pode apresentar isomeria cis/trans.
2) O retinol apresenta várias duplas ligações e,
portanto, é um composto que pode apresentar
isomeria óptica.
3) A 10- hidroxitriptilina apresenta um carbono com
quatro ligações diferentes e, portanto, apresenta
isomeria óptica; e também uma dupla ligação que
permite a isomeria cis/trans.
De acordo com a fórmula estrutural dos compostos
apresentados, analise as afirmações seguintes. 1) A talidomida apresenta apenas um carbono com
quatro ligações diferentes e, portanto, é um
composto que pode apresentar isomeria cis/trans.
2) O retinol apresenta várias duplas ligações e,
portanto, é um composto que pode apresentar
isomeria óptica.
3) A 10- hidroxitriptilina apresenta um carbono com
quatro ligações diferentes e, portanto, apresenta
isomeria óptica; e também uma dupla ligação que
permite a isomeria cis/trans.
Está(ão) correta(s) a(s) afirmativa(s):