Questões de Vestibular UNB 2011 para Vestibular, Prova 2
Foram encontradas 44 questões
O nitrato de amônio pode ser produzido por uma reação de neutralização entre ácido nítrico e NH3.
Considerando-se o rendimento de 100% para a reação de combustão do nitrato de amônio, é correto afirmar que a quantidade de explosivo utilizada na referida demolição da arquibancada do estádio Mané Garrincha produziu mais de 9,0 × 105 kJ de energia.
Por meio de filtração simples ou centrifugação de uma solução aquosa não saturada de nitrato de amônio, é possível a obtenção de nitrato de amônio sólido.
Após se balancear a equação xNH3 + yO2 ? zN2 + wH2O — que representa a combustão da amônia — usando-se os menores valores inteiros positivos para seus coeficientes estequiométricos, verifica-se que o resultado da soma x + y + z + w é um múltiplo inteiro de 5.
O percentual em massa de nitrogênio presente em todo o explosivo usado para demolir a arquibancada do estádio Mané Garrincha foi de
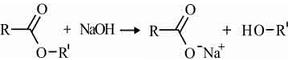
A equação a seguir, em que R e R' são grupos alquilas genéricos, representa uma reação típica de saponificação, na qual um éter reage com uma base para formar sal de ácido carboxílico e álcool.
Caso uma solução contendo NaOH reaja com o alumínio metálico contido em um recipiente e produza o aluminato (AlO33- ), outro produto dessa reação será um gás explosivo, o hidrogênio.
Sabe-se que o pH de alvejantes formados por soluções aquosas de hipoclorito de sódio é superior a 7. Isso se deve ao fato de o NaClO, ao reagir com a água, produzir o ácido hipocloroso (HClO), o que aumenta a razão [OH- ]/[H3O+ ] no meio.
A parte hidrofílica de uma molécula de detergente é, geralmente, uma cadeia carbônica apolar capaz de interagir com a gordura; a região hidrofóbica, que pode ser um grupamento iônico, é capaz de interagir com a água, por ser polar.
Questão discursiva
No sistema mostrado na figura abaixo, um frasco aberto contendo éter etílico está inserido em um béquer maior, termicamente isolado, contendo álcool etílico. Considerando as temperaturas de ebulição e de fusão mostradas na tabela abaixo e que o sistema descrito na figura esteja, inicialmente, à temperatura de 30 ºC e, ainda, que não haja evaporação do etanol, esboce uma curva que descreva, qualitativamente, a variação da temperatura do etanol, em função do tempo, monitorada durante o processo de evaporação do éter etílico, até metade do seu volume.

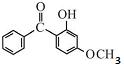
Considerando-se a figura a seguir, que representa a estrutura da 3-benzofenona usada em protetores de radiação solar, é correto afirmar que, nessa molécula, há uma carbonila cetônica ligada a dois anéis aromáticos, uma função álcool cuja hidroxila fenólica está ligada a um carbono terciário e uma função aldeído em posição meta em relação a essa hidroxila.
A presença de ligações de hidrogênio entre os hidrogênios vizinhos das moléculas de água do gelo faz que esse sólido tenha densidade maior que a água líquida e, portanto, flutue sobre ela.
Parte dos 51% da energia absorvida pela superfície da Terra permanece retida na forma de biomassa.
Considere que um painel com eficiência de 50% na conversão da radiação solar em calor esteja instalado em uma região onde a quantidade de energia irradiada pelo Sol é de 334,4 kJ por minuto. Nessa situação, assumindo-se que a água tem calor específico de 4,18 J/g °C e densidade de 1g/cm³ , o tempo necessário para se elevar a temperatura de 500 L de água de 25 ºC para 45 ºC é igual a
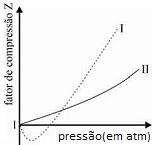
Considere que os gases da natureza, que são chamados de gases reais, tenham propriedades diferentes daquelas preditas pela lei dos gases ideais. Considere, ainda, o fator de compressão Z, que é a razão entre o volume molar do gás real e o volume molar de um gás ideal nas mesmas condições. Nesse caso, é correto afirmar que, no gráfico a seguir, da variação de Z em função da pressão, as curvas I e II representam, respectivamente, o comportamento dos gases NH3 e H2.
De acordo com o modelo de Thomson, o hidrogênio é constituído por 1 próton, 1 elétron e 1 nêutron.
As moléculas dos gases SO2 e CO2 apresentam geometria angular e são polares.
O gás carbônico é um óxido de característica ácida, pois, ao reagir com a água, produz ácido carbônico.
Se o fluxo de prótons por segundo nas imediações da Terra for de 7 prótons por centímetro quadrado na direção radial ao Sol, então o Sol estará emitindo mais de 1030 prótons por segundo.
Questão Discursiva
Em um frasco de 1,0 L, foram colocados, a determinada temperatura, 0,880 g de N2O e 1,760 g de O2 gasosos, para reagir. Após se estabelecer o equilíbrio químico, foi formado 1,012 g de gás NO2. Considerando essas condições, calcule a concentração molar de equilíbrio do O2 e multiplique o resultado por 104 . Para marcação no Caderno de Respostas, despreze, caso exista, a parte fracionária do resultado obtido, após ter efetuado todos os cálculos solicitados.
R:385


