Questões de Vestibular UNB 2015 para Vestibular - 2° Dia
Foram encontradas 43 questões

Em 2013, uma das descobertas de maior importância do
ponto de vista tecnológico foi a criação de unidades fotovoltaicas
à base de perovskita, termo que designa um tipo de óxido com
fórmula geral ABO3, em que A e B representam cátions metálicos.
Um exemplo típico é o CaTiO3. A unidade básica do cristal de uma
perovskita consiste na estrutura cúbica mostrada na figura acima,
em que cada um de oito cátions “A” ocupa um dos vértices do cubo;
seis íons oxigênio estão nos centros das faces do cubo, formando
um octaedro regular; e um cátion “B” está no centro do cubo.
Considerando essas informações e que o número de Avogadro seja igual a 6,0 × 1023, julgue o item.
O número de átomos de cálcio presentes em 27,2 g de CaTiO3
é 1,2 × 1023.

Em 2013, uma das descobertas de maior importância do
ponto de vista tecnológico foi a criação de unidades fotovoltaicas
à base de perovskita, termo que designa um tipo de óxido com
fórmula geral ABO3, em que A e B representam cátions metálicos.
Um exemplo típico é o CaTiO3. A unidade básica do cristal de uma
perovskita consiste na estrutura cúbica mostrada na figura acima,
em que cada um de oito cátions “A” ocupa um dos vértices do cubo;
seis íons oxigênio estão nos centros das faces do cubo, formando
um octaedro regular; e um cátion “B” está no centro do cubo.
Considerando essas informações e que o número de Avogadro seja igual a 6,0 × 1023, julgue o item.
Se um plano contém alguma face do octaedro, então esse plano
contém um único vértice do cubo.

Em 2013, uma das descobertas de maior importância do
ponto de vista tecnológico foi a criação de unidades fotovoltaicas
à base de perovskita, termo que designa um tipo de óxido com
fórmula geral ABO3, em que A e B representam cátions metálicos.
Um exemplo típico é o CaTiO3. A unidade básica do cristal de uma
perovskita consiste na estrutura cúbica mostrada na figura acima,
em que cada um de oito cátions “A” ocupa um dos vértices do cubo;
seis íons oxigênio estão nos centros das faces do cubo, formando
um octaedro regular; e um cátion “B” está no centro do cubo.
Considerando essas informações e que o número de Avogadro seja igual a 6,0 × 1023, julgue o item.
Se a for a medida da aresta do cubo, então a medida da aresta
do octaedro será 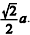

Em 2013, uma das descobertas de maior importância do
ponto de vista tecnológico foi a criação de unidades fotovoltaicas
à base de perovskita, termo que designa um tipo de óxido com
fórmula geral ABO3, em que A e B representam cátions metálicos.
Um exemplo típico é o CaTiO3. A unidade básica do cristal de uma
perovskita consiste na estrutura cúbica mostrada na figura acima,
em que cada um de oito cátions “A” ocupa um dos vértices do cubo;
seis íons oxigênio estão nos centros das faces do cubo, formando
um octaedro regular; e um cátion “B” está no centro do cubo.
Considerando essas informações e que o número de Avogadro seja igual a 6,0 × 1023, julgue o item.
No CaTiO3, o número de oxidação do Ti é +2.

Em 2013, uma das descobertas de maior importância do
ponto de vista tecnológico foi a criação de unidades fotovoltaicas
à base de perovskita, termo que designa um tipo de óxido com
fórmula geral ABO3, em que A e B representam cátions metálicos.
Um exemplo típico é o CaTiO3. A unidade básica do cristal de uma
perovskita consiste na estrutura cúbica mostrada na figura acima,
em que cada um de oito cátions “A” ocupa um dos vértices do cubo;
seis íons oxigênio estão nos centros das faces do cubo, formando
um octaedro regular; e um cátion “B” está no centro do cubo.
Considerando essas informações e que o número de Avogadro seja igual a 6,0 × 1023, julgue o item que é do tipo C.
Suponha que uma amostra de água esteja contaminada pela dissolução de uma pequena quantidade de CaTiO3. Nesse caso, o composto que possibilitaria a neutralização dessa amostra de água contaminada é
H2SO4.
Nos polímeros condutores, a flexibilidade e a facilidade de processamento típicas dos polímeros são combinadas com propriedades ópticas e eletrônicas de metais e semicondutores. Nesse tipo de polímero, a presença de ligações duplas alternadas faz que os elétrons π estejam deslocalizados devido à ressonância, efeito responsável pela condutividade elétrica do material. O poliacetileno, polímero de adição do acetileno (etino), foi o primeiro polímero condutor sintetizado.

Considerando o texto e a estrutura do polietileno apresentados acima, julgue o próximo item.
Se for feita polimerização por adição do 1,3-butadieno, será
obtido um polímero condutor.
Nos polímeros condutores, a flexibilidade e a facilidade de processamento típicas dos polímeros são combinadas com propriedades ópticas e eletrônicas de metais e semicondutores. Nesse tipo de polímero, a presença de ligações duplas alternadas faz que os elétrons π estejam deslocalizados devido à ressonância, efeito responsável pela condutividade elétrica do material. O poliacetileno, polímero de adição do acetileno (etino), foi o primeiro polímero condutor sintetizado.

Considerando o texto e a estrutura do polietileno apresentados acima, julgue o próximo item.
Na água, a solubilidade do poliacetileno é elevada porque esse
polímero forma facilmente ligações de hidrogênio com esse
solvente.

A partir da polimerização de determinado monômero,
realizada em solução com duas diferentes condições reacionais,
chegou-se a polímeros com diferentes distribuições de
massas molares, conforme ilustrado na figura acima. Ao final
dos procedimentos de síntese, as duas soluções obtidas —
uma contendo o polímero A (solução I) e outra, o polímero B
(solução II) — tinham concentrações iguais, em g/L.
Com base nessa situação e considerando que os comportamentos das soluções sejam ideais e que os polímeros sejam estáveis na temperatura de ebulição do solvente empregado em suas sínteses, julgue o item.
O ponto de fusão do polímero A é mais elevado que o do
polímero B.

A partir da polimerização de determinado monômero,
realizada em solução com duas diferentes condições reacionais,
chegou-se a polímeros com diferentes distribuições de
massas molares, conforme ilustrado na figura acima. Ao final
dos procedimentos de síntese, as duas soluções obtidas —
uma contendo o polímero A (solução I) e outra, o polímero B
(solução II) — tinham concentrações iguais, em g/L.
Com base nessa situação e considerando que os comportamentos das soluções sejam ideais e que os polímeros sejam estáveis na temperatura de ebulição do solvente empregado em suas sínteses, julgue o item.
A separação dos polímeros a partir da solução obtida ao final
de cada reação pode ser realizada pelo processo de destilação.

A partir da polimerização de determinado monômero,
realizada em solução com duas diferentes condições reacionais,
chegou-se a polímeros com diferentes distribuições de
massas molares, conforme ilustrado na figura acima. Ao final
dos procedimentos de síntese, as duas soluções obtidas —
uma contendo o polímero A (solução I) e outra, o polímero B
(solução II) — tinham concentrações iguais, em g/L.
Com base nessa situação e considerando que os comportamentos das soluções sejam ideais e que os polímeros sejam estáveis na temperatura de ebulição do solvente empregado em suas sínteses, julgue o item e faça o que se pede no item, que é do tipo C.
A respeito das soluções preparadas, assinale a opção correta.
A solução I apresenta pressão osmótica superior à da
solução II.
A chuva ácida intensifica a degradação de monumentos históricos. A maioria desses monumentos é feita de mármore, que é o carbonato de cálcio na forma cristalina, CaCO3(s), e de pedra-sabão, que tem o carbonato de sódio, Na2CO3(s), como um de seus constituintes. Esses sais, CaCO3(s) e Na2CO3(s), são pouco solúveis em água, mas, em meio ácido, o íon carbonato é convertido em H2CO3, o qual, por sua vez, decompõe-se em água e CO2, conforme a equação de equilíbrio apresentada abaixo.

A partir dessas informações, e considerando que uma solução saturada de CaCO3 apresente comportamento ideal e que a constante de solubilidade do CaCO3 seja igual a 8,1 × 10-9 , julgue o item que se segue.
O aquecimento global é uma consequência direta do fenômeno
conhecido como chuva ácida.
A chuva ácida intensifica a degradação de monumentos históricos. A maioria desses monumentos é feita de mármore, que é o carbonato de cálcio na forma cristalina, CaCO3(s), e de pedra-sabão, que tem o carbonato de sódio, Na2CO3(s), como um de seus constituintes. Esses sais, CaCO3(s) e Na2CO3(s), são pouco solúveis em água, mas, em meio ácido, o íon carbonato é convertido em H2CO3, o qual, por sua vez, decompõe-se em água e CO2, conforme a equação de equilíbrio apresentada abaixo.

A partir dessas informações, e considerando que uma solução saturada de CaCO3 apresente comportamento ideal e que a constante de solubilidade do CaCO3 seja igual a 8,1 × 10-9 , julgue o item que se segue.
Considerando os dados apresentados na tabela abaixo, verifica-se que, a 25 ºC e 1 atm, os estados físicos do CaCO3, da H2O e do CO2 são, respectivamente, sólido, líquido e gasoso.
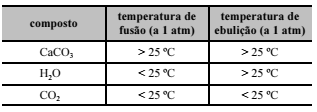
A chuva ácida intensifica a degradação de monumentos históricos. A maioria desses monumentos é feita de mármore, que é o carbonato de cálcio na forma cristalina, CaCO3(s), e de pedra-sabão, que tem o carbonato de sódio, Na2CO3(s), como um de seus constituintes. Esses sais, CaCO3(s) e Na2CO3(s), são pouco solúveis em água, mas, em meio ácido, o íon carbonato é convertido em H2CO3, o qual, por sua vez, decompõe-se em água e CO2, conforme a equação de equilíbrio apresentada abaixo.

A partir dessas informações, e considerando que uma solução saturada de CaCO3 apresente comportamento ideal e que a constante de solubilidade do CaCO3 seja igual a 8,1 × 10-9 , julgue o item que se segue.
A estrutura reproduzida abaixo corresponde à estrutura de Lewis do H2CO3.
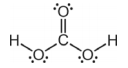
A chuva ácida intensifica a degradação de monumentos históricos. A maioria desses monumentos é feita de mármore, que é o carbonato de cálcio na forma cristalina, CaCO3(s), e de pedra-sabão, que tem o carbonato de sódio, Na2CO3(s), como um de seus constituintes. Esses sais, CaCO3(s) e Na2CO3(s), são pouco solúveis em água, mas, em meio ácido, o íon carbonato é convertido em H2CO3, o qual, por sua vez, decompõe-se em água e CO2, conforme a equação de equilíbrio apresentada abaixo.

A partir dessas informações, e considerando que uma solução saturada de CaCO3 apresente comportamento ideal e que a constante de solubilidade do CaCO3 seja igual a 8,1 × 10-9 , julgue o item que se segue.
A solubilidade do CaCO3 em água pura, a 25 ºC, é igual a
9,0 mg/L.
A chuva ácida intensifica a degradação de monumentos históricos. A maioria desses monumentos é feita de mármore, que é o carbonato de cálcio na forma cristalina, CaCO3(s), e de pedra-sabão, que tem o carbonato de sódio, Na2CO3(s), como um de seus constituintes. Esses sais, CaCO3(s) e Na2CO3(s), são pouco solúveis em água, mas, em meio ácido, o íon carbonato é convertido em H2CO3, o qual, por sua vez, decompõe-se em água e CO2, conforme a equação de equilíbrio apresentada abaixo.

A partir dessas informações, e considerando que uma solução saturada de CaCO3 apresente comportamento ideal e que a constante de solubilidade do CaCO3 seja igual a 8,1 × 10-9 , julgue o item que se segue.
200 mL de uma solução padrão de NaOH, com concentração
igual a 0,0200 mol/L, contém 1,6 g do soluto.
A chuva ácida intensifica a degradação de monumentos históricos. A maioria desses monumentos é feita de mármore, que é o carbonato de cálcio na forma cristalina, CaCO3(s), e de pedra-sabão, que tem o carbonato de sódio, Na2CO3(s), como um de seus constituintes. Esses sais, CaCO3(s) e Na2CO3(s), são pouco solúveis em água, mas, em meio ácido, o íon carbonato é convertido em H2CO3, o qual, por sua vez, decompõe-se em água e CO2, conforme a equação de equilíbrio apresentada abaixo.

A partir dessas informações, e considerando que uma solução saturada de CaCO3 apresente comportamento ideal e que a constante de solubilidade do CaCO3 seja igual a 8,1 × 10-9 , julgue o item que se segue.
O consumo dos íons carbonato em meio ácido aumenta a
solubilidade do CaCO3 e do Na2CO3, o que acelera a
degradação de monumentos, conforme mencionado no texto.
Considerando essa situação e, ainda, que as soluções apresentem comportamento ideal, que a constante de autoionização da água seja igual a 1,0 × 10-14 e que log 5 = 0,70, julgue o item.
O pH da solução padrão de NaOH é igual a 12,7.
Considerando essa situação e, ainda, que as soluções apresentem comportamento ideal, que a constante de autoionização da água seja igual a 1,0 × 10-14 e que log 5 = 0,70, julgue o item e faça o que se pede no item, que é do tipo B.
Calcule a concentração de H2SO4 na amostra de chuva ácida.
Multiplique o resultado obtido por 105
. Depois de efetuados
todos os cálculos solicitados, despreze, para a marcação no
Caderno de Respostas, a parte fracionária do resultado final
obtido, caso exista.
A primeira lâmpada comercial, desenvolvida por Thomas Edison, consistia em uma haste de carbono, que era aquecida pela passagem de uma corrente elétrica a ponto de emitir luz visível. Era, portanto, uma lâmpada incandescente, que transforma energia elétrica em energia luminosa e energia térmica. Posteriormente, passou-se a utilizar, no lugar da haste, filamentos de tungstênio, cuja durabilidade é maior. Hoje, esse tipo de lâmpada tem sido substituído pelas lâmpadas fluorescentes e de LED.
As lâmpadas fluorescentes são construídas com tubos de vidro transparente revestidos internamente e contêm dois eletrodos (um em cada ponta) e uma mistura de gases em seu interior — vapor de mercúrio e argônio, por exemplo. Quando a lâmpada fluorescente é ligada, os eletrodos geram corrente elétrica, que, ao passar através da mistura gasosa, excita seus componentes, os quais, então, emitem radiação ultravioleta. O material que reveste o tubo tem a propriedade de converter a radiação ultravioleta em luz visível, que é emitida para o ambiente.
A lâmpada de LED é mais econômica que a incandescente, pois dissipa menos energia em forma de calor. Em geral, essas lâmpadas têm eficiência de 15 lumens por watt. Um lúmen (unidade padrão do Sistema Internacional) é o fluxo luminoso emitido por uma fonte puntiforme com intensidade uniforme de 1 candela e contido em um cone de ângulo sólido de um esferorradiano. A tabela a seguir apresenta características específicas das lâmpadas incandescentes, fluorescentes e de LED.

A partir do texto acima e considerando que 6,63 × 10-34 J-s seja o valor da constante de Planck, que 3 × 108 m/s seja a velocidade da luz e que a temperatura em graus Kelvin seja exatamente igual à temperatura em graus Celsius acrescida de 273, julgue o item.
O tungstênio tem maior raio atômico e menor energia de
ionização que o carbono.
A primeira lâmpada comercial, desenvolvida por Thomas Edison, consistia em uma haste de carbono, que era aquecida pela passagem de uma corrente elétrica a ponto de emitir luz visível. Era, portanto, uma lâmpada incandescente, que transforma energia elétrica em energia luminosa e energia térmica. Posteriormente, passou-se a utilizar, no lugar da haste, filamentos de tungstênio, cuja durabilidade é maior. Hoje, esse tipo de lâmpada tem sido substituído pelas lâmpadas fluorescentes e de LED.
As lâmpadas fluorescentes são construídas com tubos de vidro transparente revestidos internamente e contêm dois eletrodos (um em cada ponta) e uma mistura de gases em seu interior — vapor de mercúrio e argônio, por exemplo. Quando a lâmpada fluorescente é ligada, os eletrodos geram corrente elétrica, que, ao passar através da mistura gasosa, excita seus componentes, os quais, então, emitem radiação ultravioleta. O material que reveste o tubo tem a propriedade de converter a radiação ultravioleta em luz visível, que é emitida para o ambiente.
A lâmpada de LED é mais econômica que a incandescente, pois dissipa menos energia em forma de calor. Em geral, essas lâmpadas têm eficiência de 15 lumens por watt. Um lúmen (unidade padrão do Sistema Internacional) é o fluxo luminoso emitido por uma fonte puntiforme com intensidade uniforme de 1 candela e contido em um cone de ângulo sólido de um esferorradiano. A tabela a seguir apresenta características específicas das lâmpadas incandescentes, fluorescentes e de LED.

A partir do texto acima e considerando que 6,63 × 10-34 J-s seja o valor da constante de Planck, que 3 × 108 m/s seja a velocidade da luz e que a temperatura em graus Kelvin seja exatamente igual à temperatura em graus Celsius acrescida de 273, julgue o item.
As ondas de calor produzidas por lâmpadas propagam-se no
vácuo.