Questões de Vestibular URCA 2019 para Vestibular - Prova Física, Matemática, Química e Biologia
Foram encontradas 60 questões
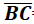 =10 e
cateto
=10 e
cateto 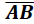 =8. Sobre BC marcamos um
ponto D tal que
=8. Sobre BC marcamos um
ponto D tal que 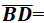 7. Nessas condições
pede-se 5/13
7. Nessas condições
pede-se 5/13 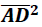
Nessas condições calcule f(f(1)) + f(f (1/2)).
Disponível em:<https://www.portaltvcariri.com.br/veja-os-beneficios-do-cha-de-camomila/> , acesso 25/11/2018 (adaptado)
A água é um poderoso solvente, capaz de dissolver um grande número de substâncias e que possui diversas propriedades. Isso é possível devido à sua geometria molecular, polaridade e força intermolecular. Essas características atribuídas à água são:
Disponível em: <http://geoparkararipe.org.br/nascentes-da-chapada-do-araripe>. Acesso em 25/11/2018. (adaptado)
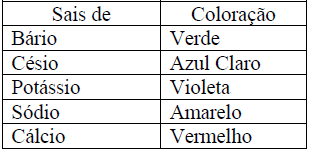
A partir da análise da Tabela Periódica, pode-se afirmar:
I. O raio atômico do sódio é menor que o do estrôncio.
II. A formação do íon Li+ requer mais energia que a do Na+, a partir de seus respectivos átomos neutros.
III. O potássio e o cloro originam íons de cargas idênticas.
IV. A espécie iônica mais estável para o magnésio é o íon Mg3+.
Está(ão) correta(s) apenas a(s) afirmativa(s):
Selênio - Assim como a vitamina E, esse mineral possui grande capacidade antioxidante, ou seja, neutraliza a ação dos radicais livres (formados devido à ação dos raios solares, poluição, fumaça de cigarro, entre outros) no nosso corpo, retardando o processo de envelhecimento e evitando o desencadeamento de algumas formas de câncer. Castanha do Pará, alimentos marinhos, fígado, carne e aves são os alimentos mais ricos em selênio.
Disponível em:<http://www.vyaestelarnoticias.com.br/post/4688/alim> . Acesso em: 20 nov. 2018.
Comparando-se esses dois elementos, verificamos que o selênio, ao combinar, tende a adquirir carga negativa, enquanto o zinco tende a adquirir carga positiva.
Qual a fórmula do composto formado entre zinco e selênio.
Uma das propriedades que determina a maior ou menor concentração de uma vitamina na urina é sua solubilidade em água.
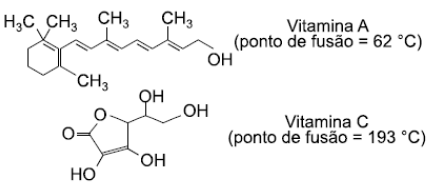
Qual dessas vitaminas é mais facilmente
eliminada na urina e qual a ligação
intermolecular é mais atuante nela.
I) 100 mL NaOH C = 0,5 mol / L. II) 100 mL KI C = 1 mol / L. III) 100 mL Pb(NO3)2 C = 1 mol / L. IV) 100 mL HNO3 C = 0,5 mol / L. V) 100 mL HNO3 C = 1,5 mol / L.
As soluções escolhidas e a massa do precipitado formado foram

Um paciente que ingerir 500 mL de solução de soro, consumirá, respectivamente, concentração em MOL/L de íons K+ , e Cl- igual a:
Dados MM (K= 39u, Na =23u e Cl = 36u).