Questões de Vestibular IF-TM 2011 para Vestibular, Prova 01
Foram encontradas 7 questões
Al2(SO4)3 + 6H2O → 2Al(OH)3 + 6 H+ + 3SO42-
O excesso de íons H+ formado tende a diminuir o pH do meio, o que pode contribuir para a interrupção da formação do Al(OH)3, atrapalhando o processo de coagulação/floculação. Em alguns casos, o excesso de H+ é removido pela alcalinidade presente nas águas naturais. Se a alcalinidade do meio não for suficiente, o pH deve ser aumentado pela adição de outras substâncias. Disponível em: <http://qnesc.sbq.org.br/online/cadernos/01/aguas.pdf> Acesso em: 1 nov. 2011 (adaptado).
É possível aumentar o pH do meio aquoso adicionando-se a seguinte substância:
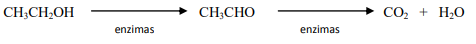
Disponível em: < http://qnesc.sbq.org.br/online/qnesc05/quimsoc.pdf > Acesso em: 1 nov. 2011 (adaptado).
Dadas as massas molares (g.mol-1): C = 12, H = 1, O = 16
De acordo com os seus conhecimentos de química é incorreto afirmar que:
Disponível em < http://www.consciencia.net/2005/mês/10/taguchi-liebig.html> Acesso em: 1 nov. 2011.
Para suprir as necessidades das plantas por nitrogênio e potássio, podem ser utilizadas entre outras substâncias, o NaNO3 e o KCl.
Dadas as massas molares (g.mol-1): Na = 23, N = 14, O = 16, K = 39, Cl = 35,5
Estas substâncias apresentam em sua fórmula, respectivamente, teores de nitrogênio e potássio aproximadamente iguais a:
O gás hidrogênio é muito utilizado em diversos processos industriais, tais como: síntese de amônia, hidrogenação de óleos e gorduras, etc. Uma das formas utilizadas para a produção do gás hidrogênio é a partir da reação de reforma do metano. Este processo, em condições adequadas, ocorre através de duas reações representadas pelas equações 1 e 2, já a equação 3 representa a reação global deste processo.
Equação 1: CH4(g) + H2O(g) → CO(g) + 3H2(g) ∆ H = +206 kJ
Equação 2: CO(g) + H2O(g) → CO2(g) + H2(g) ∆ H = - 41 kJ
Equação 3: CH4(g) + 2H2O(v) → CO2(g) + 4H2(g)
Dados: Massas molares (g.mol-1): C = 12, H = 1, O = 16
Sobre as substâncias e as reações representadas por estas equações é incorreto afirmar que:
O gás hidrogênio é muito utilizado em diversos processos industriais, tais como: síntese de amônia, hidrogenação de óleos e gorduras, etc. Uma das formas utilizadas para a produção do gás hidrogênio é a partir da reação de reforma do metano. Este processo, em condições adequadas, ocorre através de duas reações representadas pelas equações 1 e 2, já a equação 3 representa a reação global deste processo.
Equação 1: CH4(g) + H2O(g) → CO(g) + 3H2(g) ∆ H = +206 kJ
Equação 2: CO(g) + H2O(g) → CO2(g) + H2(g) ∆ H = - 41 kJ
Equação 3: CH4(g) + 2H2O(v) → CO2(g) + 4H2(g)
Dados: Massas molares (g.mol-1): C = 12, H = 1, O = 16
Para produzir 500 gramas de H2 pela reação representada na equação 3, a quantidade de metano consumida
será igual a