Questões de Vestibular UFT 2010 para Vestibular, Prova 02
Foram encontradas 8 questões
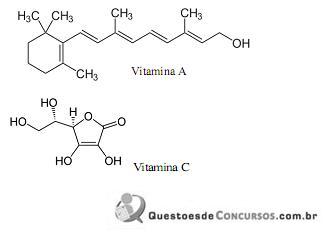
Com base nas estruturas apresentadas, NÃO É CORRETO o que se afirma em:
I. A eletronegatividade é a força de atração exercida sobre os elétrons de uma ligação, e relaciona-se com o raio atômico de forma diretamente proporcional, pois à distância núcleo-elétrons da ligação é menor.
II. A eletroafinidade é a energia liberada quando um átomo isolado, no estado gasoso, captura um elétron; portanto, quanto menor o raio atômico, menor a afinidade eletrônica.
III. Energia (ou potencial) de ionização é a energia mínima necessária para remover um elétron de um átomo gasoso e isolado, em seu estado fundamental.
IV. O tamanho do átomo, de modo geral, varia em função do número de níveis eletrônicos (camadas) e do número de prótons (carga nuclear).
É CORRETO o que afirma em:
dado: constante de Faraday: F = 96.500C/mol.
1s 2 2s 2 2p6 3s 2 3p6 4s 2 3d10 4p4
Podemos propor, para este elemento:
I. O número de prótons no núcleo atômico é 34.
II. É um elemento pertencente ao grupo IVA da Tabela Periódica.
III. O último elétron distribuído na camada de valência possui o número quântico magnético igual a zero.
IV. A subcamada de menor energia, pertencente à camada de valência é a 4s.
Analise as proposições e marque a opção CORRETA:
É CORRETO afirmar:
A manutenção da vida dos animais depende da energia que é obtida do consumo de alimentos como carboidratos, gorduras e proteínas. No entanto, carboidratos são as principais fontes de energia dos animais, estes sofrem combustão durante a respiração celular. Deve-se observar que cada mol de glicose em processo de combustão libera 720 kcal, conforme equação abaixo:
C6H12O6 + 6O2(g) → 6CO2(g) + 6H2O(l) + energia
Determine a variação de entalpia de formação (ΔHf) do monômero glicose (C6H12O6), a partir dos valores de ΔHf do CO2 e da H2O que são produtos da combustão deste açúcar.
C(s) + O2(g) → CO2(g) ΔHf = -95 kcal/mol
H2(g) + ½ O2(g) → H2O(l) ΔHf = -70 Kcal/mol
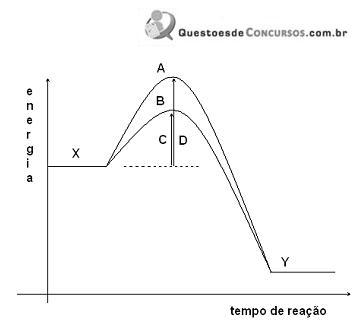
Com a análise do gráfico é CORRETO afirmar: