Questões de Vestibular UEL 2017 para Vestibular
Foram encontradas 6 questões
Leia o texto a seguir e responda à questão.
O rompimento da barragem da Samarco em novembro de 2015 em Mariana (MG) é um dos maiores desastres do século XXI, considerando o volume de rejeitos despejados no meio ambiente.
Pesquisadores apontam que o resíduo sólido da barragem é constituído por Goethita 60%, Hematita (óxido de ferro) 23%, Quartzo (SiO2) 11,0%, Caulinita Al2Si2O5(OH)4 5,9% e alguns metais, tais como bário, chumbo, crômio, manganês, sódio, cádmio, mercúrio e arsênio.
(Adaptado. Disponível em: <http://agenciabrasil.ebc.com.br/ geral/noticia/2016-01/desastre-em-mariana-e-o-maior-acidentemundial-com-barragens-em-100-anos>. Acesso em: 26 abr 2017.)
Dados: Massas atômicas de: Fe = 56 u; O = 16 u;
Si = 28 u; Al = 27 u; H = 1 u.
Leia o texto a seguir e responda à questão.
O rompimento da barragem da Samarco em novembro de 2015 em Mariana (MG) é um dos maiores desastres do século XXI, considerando o volume de rejeitos despejados no meio ambiente.
Pesquisadores apontam que o resíduo sólido da barragem é constituído por Goethita 60%, Hematita (óxido de ferro) 23%, Quartzo (SiO2) 11,0%, Caulinita Al2Si2O5(OH)4 5,9% e alguns metais, tais como bário, chumbo, crômio, manganês, sódio, cádmio, mercúrio e arsênio.
(Adaptado. Disponível em: <http://agenciabrasil.ebc.com.br/ geral/noticia/2016-01/desastre-em-mariana-e-o-maior-acidentemundial-com-barragens-em-100-anos>. Acesso em: 26 abr 2017.)
Dados: Massas atômicas de: Fe = 56 u; O = 16 u;
Si = 28 u; Al = 27 u; H = 1 u.
A reação química global não balanceada que ocorre durante o funcionamento de baterias de níquel-cádmio pode ser representada pela equação a seguir.
Cd(s)+Ni(OH)3(s) ←→ CdO(s)+Ni(OH)2(s)+H2O(l)
Com base nos conhecimentos sobre células galvânicas e reações de oxidação-redução, considere as afirmativas a seguir.
I. Na bateria de níquel-cádmio, os elétrons fluem do Cd(s) para o Ni(OH)3(s), produzindo energia elétrica por meio de um processo espontâneo. II. O elemento Cd perde elétrons, ocasionando aumento do seu número de oxidação e atuando como agente redutor. III. Na equação balanceada, as espécies Cd(s) e Ni(OH)3(s) apresentam os mesmos coeficientes estequiométricos. IV. Quando a bateria de níquel-cádmio está funcionando, o eletrodo de Ni(OH)3(s) é oxidado, no cátodo, a Ni(OH)2(s).
Assinale a alternativa correta.
Diferentes métodos são utilizados por profissionais da área de Ciência Forense para determinar a quanto tempo o indivíduo veio a óbito. Pesquisadores brasileiros reportaram que existe uma relação linear entre a concentração de Fe2+ no corpo vítreo do olho com o intervalo pós-morte. Este método é baseado em uma reação de Fe2+ com orto-fenantrolina como agente cromogênico realizada em um dispositivo de papel, cujo produto da reação apresenta coloração alaranjada. Desta forma, quanto maior o tempo de intervalo pós-morte maior a intensidade de coloração do produto.
(Adaptado de: GARCIA, P.T.; GABRIEL, E.F.M.; PESSÔA, G.S.; SANTOS JUNIOR, J.C.; MOLLO FILHO, P. C.; GUIDUGLI, R.B.F.; HÖEHR, N.F.; ARRUDA, M.A.Z.; COLTRO, W.K.T, Analytica Chimica Acta, v. 974, n.29, p.69-74, 2017).
A equação química da reação de Fe2+ com orto-fenantrolina é apresentada na figura seguir.
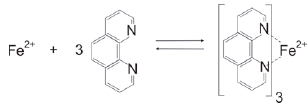
Considerando os conceitos, as definições de ácido e base e a reação química apresentada, assinale a alternativa correta.
Durante a vida e após a morte, o corpo humano serve de abrigo e alimento para diversos tipos de bactérias que produzem compostos químicos, como a cadaverina e a putrescina. Essas moléculas se formam da decomposição de proteínas, sendo responsáveis, em parte, pelo cheiro de fluidos corporais nos organismos vivos e que também estão associadas ao mau odor característico dos cadáveres no processo de putrefação.
(Adaptado de: <http://qnint.sbq.org.br/novo/index.php?hash= molecula.248>. Acesso em: 22 maio 2017.)
As fórmulas estruturais da cadaverina e da putrescina são apresentadas a seguir.
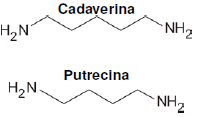
Com base nos conhecimentos sobre funções orgânicas e propriedades de compostos orgânicos, assinale a alternativa que apresenta, corretamente, a característica dessas moléculas.
( ) A adição de um catalisador na mistura aumenta o rendimento da reação e promove a formação de outros produtos. ( ) A diminuição do volume ocupado pela mistura gasosa resulta no aumento da velocidade da reação. ( ) A velocidade de decomposição de CH4 é a metade da velocidade de formação de H2O. ( ) A velocidade da reação dobra quando as concentrações de CH4 e O2 forem duplicadas. ( ) A velocidade de formação dos produtos, CO2(g) e H2O(g), da reação de combustão é a mesma.
Assinale a alternativa que contém, de cima para baixo, a sequência correta.