Questões de Vestibular UEPB 2009 para Vestibular, QUÍMICA E FÍSICA - 2º DIA
Foram encontradas 20 questões
Assinale a alternativa verdadeira.
Fritz Haber, prêmio Nobel de química em 1918, ficou famoso por causa da síntese da amônia a partir do nitrogênio atmosférico, alguns meses antes da Primeira Guerra Mundial (1914-1918). A produção inicial, entre três e cinco toneladas de nitrato, aumentou rapidamente com as contribuições de Carl Bosch: em 1918 ultrapassava 300.000 toneladas anuais. O processo Haber-Bosch é uma reação entre o nitrogênio e o hidrogênio para produzir amoníaco. Esta reação é catalisada com ferro, sob as condições de 200 atmosferas de pressão e uma temperatura de 450°C.
( ) A amônia é classificada como um composto orgânico heterogêneo, pois apresenta o heteroátomo nitrogênio em sua estrutura.
( ) É quimicamente impossível obter-se ácido nítrico a partir da amônia, tendo em vista que esta ultima é uma base.
( ) Fritz Haber foi devidamente reconhecido como um importante químico para o mundo em seu tempo, chegando a ser congratulado em 1918 com o premio Nobel de química, devido à grande contribuição com a obtenção do Zyklon B e de outras substâncias de aplicações semelhantes.
( ) Uma grande importância da amônia nos tempos de Haber, assim como é ainda hoje, foi sua aplicação para a produção de produtos essenciais aos humanos, como os fertilizantes, hoje tão importantes para a produção de alimentos no mundo.
( ) O processo de produção da amônia desenvolvido por Haber e aperfeiçoado por Bosch teve influência direta na Primeira Guerra Mundial chegando a prolongá-la.
Indique a seqüência correta
Fritz Haber, prêmio Nobel de química em 1918, ficou famoso por causa da síntese da amônia a partir do nitrogênio atmosférico, alguns meses antes da Primeira Guerra Mundial (1914-1918). A produção inicial, entre três e cinco toneladas de nitrato, aumentou rapidamente com as contribuições de Carl Bosch: em 1918 ultrapassava 300.000 toneladas anuais. O processo Haber-Bosch é uma reação entre o nitrogênio e o hidrogênio para produzir amoníaco. Esta reação é catalisada com ferro, sob as condições de 200 atmosferas de pressão e uma temperatura de 450°C.
Durante décadas, o DDT(dicloro-difenil-tricloroetano) foi largamente usado como inseticida até ser comprovado que, além de provocar câncer, demora de 4 a 30 anos para se degradar. O DDT foi utilizado na Segunda Guerra Mundial para prevenção de tifo em soldados, que o utilizavam também para o combate a piolhos. Posteriormente foi usado na agropecuária, no Brasil e no mundo, dado seu baixo preço e elevada eficiência. Especialistas afirmam que o principal problema do DDT é sua ação indiscriminada, que atinge tanto as pragas quanto o resto da fauna e flora da área afetada. O DDT também se infiltra na água, contaminando os mananciais.

I - O DDT foi utilizado na Segunda Guerra Mundial como arma química devido ao efeito mortífero que esta substância provoca aos seres humanos causando sua morte por febre tifóide.
II - O DDT é uma substância muito instável. Mesmo a temperatura ambiente, ele sofre degradação térmica resultando no produto DDE.
III - O DDE apresenta quatro átomos de cloro e oito átomos de hidrogênio em sua estrutura.
IV - O DDT apresenta átomo de carbono assimétrico e, por conseqüência, atividade óptica.
Estão ERRADOS
Durante décadas, o DDT(dicloro-difenil-tricloroetano) foi largamente usado como inseticida até ser comprovado que, além de provocar câncer, demora de 4 a 30 anos para se degradar. O DDT foi utilizado na Segunda Guerra Mundial para prevenção de tifo em soldados, que o utilizavam também para o combate a piolhos. Posteriormente foi usado na agropecuária, no Brasil e no mundo, dado seu baixo preço e elevada eficiência. Especialistas afirmam que o principal problema do DDT é sua ação indiscriminada, que atinge tanto as pragas quanto o resto da fauna e flora da área afetada. O DDT também se infiltra na água, contaminando os mananciais.

Durante décadas, o DDT(dicloro-difenil-tricloroetano) foi largamente usado como inseticida até ser comprovado que, além de provocar câncer, demora de 4 a 30 anos para se degradar. O DDT foi utilizado na Segunda Guerra Mundial para prevenção de tifo em soldados, que o utilizavam também para o combate a piolhos. Posteriormente foi usado na agropecuária, no Brasil e no mundo, dado seu baixo preço e elevada eficiência. Especialistas afirmam que o principal problema do DDT é sua ação indiscriminada, que atinge tanto as pragas quanto o resto da fauna e flora da área afetada. O DDT também se infiltra na água, contaminando os mananciais.

Durante décadas, o DDT(dicloro-difenil-tricloroetano) foi largamente usado como inseticida até ser comprovado que, além de provocar câncer, demora de 4 a 30 anos para se degradar. O DDT foi utilizado na Segunda Guerra Mundial para prevenção de tifo em soldados, que o utilizavam também para o combate a piolhos. Posteriormente foi usado na agropecuária, no Brasil e no mundo, dado seu baixo preço e elevada eficiência. Especialistas afirmam que o principal problema do DDT é sua ação indiscriminada, que atinge tanto as pragas quanto o resto da fauna e flora da área afetada. O DDT também se infiltra na água, contaminando os mananciais.

Para calcular a velocidade de uma reação, podemos medir a quantidade de reagentes consumidos ou a quantidade de produtos formados por unidade de tempo. A figura abaixo representa um experimento no qual misturou-se 50 mL de uma solução de ácido clorídrico 0,1 mol L-1 com um grama de magnésio metálico. Observe o gráfico do volume do gás Hidrogênio formado versus tempo.

I - No instante t = 60 s, a velocidade da produção do gás hidrogênio é maior que a velocidade de consumo de Mg (em mols/s).
II - Em qualquer instante após o início da reação, a quantidade de matéria (mol) produzida de gás hidrogênio é o dobro da consumida de ácido clorídrico.
III - A massa de gás hidrogênio produzida é sempre menor que a massa de ácido consumida, em qualquer instante.
Está(ão) correto(s):
Para calcular a velocidade de uma reação, podemos medir a quantidade de reagentes consumidos ou a quantidade de produtos formados por unidade de tempo. A figura abaixo representa um experimento no qual misturou-se 50 mL de uma solução de ácido clorídrico 0,1 mol L-1 com um grama de magnésio metálico. Observe o gráfico do volume do gás Hidrogênio formado versus tempo.

Desde eras remotas o ser humano extrai da natureza corantes, numa busca incessante pela diversidade de cores. São exemplos, o índigo, extraído da planta Indigofera tinctoria, e a brasileína, da Caesalpinia echinata (pau-brasil), entre muitos outros extraídos de vegetais. No entanto, poucas substâncias de origem animal foram utilizadas como corantes têxteis. Apesar disso, os corantes vermelhos provenientes de insetos, o quermes e a cochinilha, foram muito apreciados. Por exemplo, o Império Romano valorizava-os tanto que era um dos tributos que as nações conquistadas tinham de pagar. O imperador Nero chegou a punir com a morte o uso da púrpura de Tiro, corante obtido a partir de espécies de um molusco do género Murex.
I - O índigo, por ser um corante encontrado na natureza, não reage com o tecido e, portanto, permite uma ligação muito mais intensa.
II - Corantes naturais como a brasileína têm a grande vantagem de serem obtidos de fontes naturais renováveis em curto prazo, além de serem mais saudáveis aos seres humanos porque não contêm química.
III - A produção de corantes artificiais tem contribuído para a preservação de espécies vegetais e animais, tendo proporcionado a obtenção de cores bem diversificadas em relação às fontes naturais.
Está(ão) correto(s):
Desde eras remotas o ser humano extrai da natureza corantes, numa busca incessante pela diversidade de cores. São exemplos, o índigo, extraído da planta Indigofera tinctoria, e a brasileína, da Caesalpinia echinata (pau-brasil), entre muitos outros extraídos de vegetais. No entanto, poucas substâncias de origem animal foram utilizadas como corantes têxteis. Apesar disso, os corantes vermelhos provenientes de insetos, o quermes e a cochinilha, foram muito apreciados. Por exemplo, o Império Romano valorizava-os tanto que era um dos tributos que as nações conquistadas tinham de pagar. O imperador Nero chegou a punir com a morte o uso da púrpura de Tiro, corante obtido a partir de espécies de um molusco do género Murex.
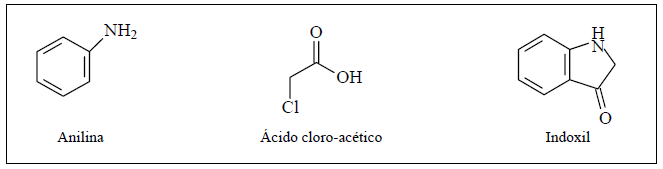
Sabendo que as estruturas planares dos compostos anilina, ácido cloro-acético e indoxil são apresentadas abaixo, qual a estrutura plana da N-fenil-glicina?
Desde eras remotas o ser humano extrai da natureza corantes, numa busca incessante pela diversidade de cores. São exemplos, o índigo, extraído da planta Indigofera tinctoria, e a brasileína, da Caesalpinia echinata (pau-brasil), entre muitos outros extraídos de vegetais. No entanto, poucas substâncias de origem animal foram utilizadas como corantes têxteis. Apesar disso, os corantes vermelhos provenientes de insetos, o quermes e a cochinilha, foram muito apreciados. Por exemplo, o Império Romano valorizava-os tanto que era um dos tributos que as nações conquistadas tinham de pagar. O imperador Nero chegou a punir com a morte o uso da púrpura de Tiro, corante obtido a partir de espécies de um molusco do género Murex.
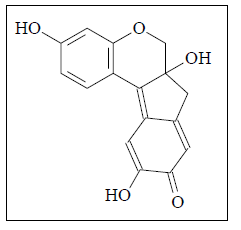
Um dos corantes do pau-brasil é a brasileína, com fórmula estrutural plana apresentada ao lado. Esta substância é colorida, pois possui varias ligações π conjugadas e um anel aromático em sua estrutura. Quantos elétrons π (pi) e quantas ligações σ (sigma) existem nesta molécula?
Desde eras remotas o ser humano extrai da natureza corantes, numa busca incessante pela diversidade de cores. São exemplos, o índigo, extraído da planta Indigofera tinctoria, e a brasileína, da Caesalpinia echinata (pau-brasil), entre muitos outros extraídos de vegetais. No entanto, poucas substâncias de origem animal foram utilizadas como corantes têxteis. Apesar disso, os corantes vermelhos provenientes de insetos, o quermes e a cochinilha, foram muito apreciados. Por exemplo, o Império Romano valorizava-os tanto que era um dos tributos que as nações conquistadas tinham de pagar. O imperador Nero chegou a punir com a morte o uso da púrpura de Tiro, corante obtido a partir de espécies de um molusco do género Murex.
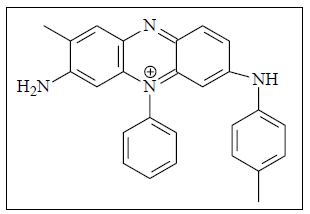
A história mostra que a determinação da estrutura da mauveína não foi fácil de ser alcançada. De modo satisfatório, a estrutura química deste corante só foi conseguida em 1994. De fato existem quatro compostos denominados de mauveína, sendo um deles (mauveína A) apresentado ao lado.
Com base nesta estrutura, pode-se dizer que a mauveína A é um composto
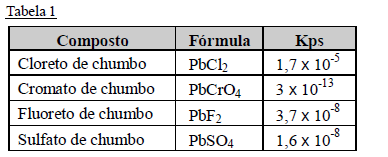
Com base nas informações acima escolha a alternativa que contém a substância mais indicada para a identificação do chumbo II por precipitação em meio aquoso. Considere que todos os sais de metais alcalinos são muito solúveis em água.

I - A ausência de melanina é característica do albinismo. Isso se explica pelo excessivo número de grupos aldeídos presentes na estrutura da eumelanina.
II - A eumelanina possui grupos amino e carbonilas (provenientes de quinona).
III - O aumento de melanina permite que sinapses ocorram entre os neurônios em um tempo mais curto, aumentando a capacidade cognitiva dos indivíduos, pois atua diretamente no córtex cerebral.
Está(ão) correto(s):

A tartrazina é uma substância muito utilizada para colorir alimentos. No entanto, estudos apresentam a ocorrência de alergias principalmente em pessoas sensíveis ao ácido acetilsalicílico, porém sem resultados conclusivos. Para efeito da utilização da tartrazina como aditivo alimentar, a Agência Nacional de Vigilância Sanitária (ANVISA) define seu limite máximo de 30 mg por 100 gramas de amostra e um IDA (Ingestão Diária Aceitável) de 7,5 mg/Kg de peso corpóreo para tartrazina.
A tartrazina é uma substância muito utilizada para colorir alimentos. No entanto, estudos apresentam a ocorrência de alergias principalmente em pessoas sensíveis ao ácido acetilsalicílico, porém sem resultados conclusivos. Para efeito da utilização da tartrazina como aditivo alimentar, a Agência Nacional de Vigilância Sanitária (ANVISA) define seu limite máximo de 30 mg por 100 gramas de amostra e um IDA (Ingestão Diária Aceitável) de 7,5 mg/Kg de peso corpóreo para tartrazina.
A condutividade térmica é uma propriedade muito importante na seleção de materiais para diversas aplicações. Em muitas situações são necessários materiais isolantes, isto é, com baixa condutividade térmica, enquanto que em outras são necessários materiais com elevada condutividade térmica. Por exemplo, os materiais utilizados para aquecimento devem possuir elevada condutividade térmica. De igual modo, a condutividade térmica de alguns materiais para aplicações elétricas ou eletrônicas é essencial para dissipar o calor que se produz por efeito Joule. A capacidade calorífica específica ou calor específico(Cp) é a quantidade de calor necessária para elevar, de um grau Celsius, a temperatura de um grama da substância a pressão constante. Abaixo estão apresentados a condutividade térmica e o calor específico de alguns materiais.

Julgue os itens abaixo relativos à situação hipotética acima, no que se refere ao equilíbrio térmico alcançado quando a água volta a entrar em ebulição.
I - As três peças estão em equilíbrio térmico com a água mas apresentam temperaturas diferentes umas das outras.
II - As três peças recebem a mesma quantidade de calor da água, tendo em vista que apresentam a mesma diferença de temperatura em relação à água em ebulição.
III - A peça de cobre é a que recebe mais calor, pois possui a maior condutividade térmica.
IV - A peça de poliestireno é a que recebe mais calor, porque apresenta a maior capacidade calorífica das três. No equilíbrio térmico, esta peça fica com a mesma temperatura (100°C) das demais e também da água que a envolve.
Está(ão) correto(s):
A condutividade térmica é uma propriedade muito importante na seleção de materiais para diversas aplicações. Em muitas situações são necessários materiais isolantes, isto é, com baixa condutividade térmica, enquanto que em outras são necessários materiais com elevada condutividade térmica. Por exemplo, os materiais utilizados para aquecimento devem possuir elevada condutividade térmica. De igual modo, a condutividade térmica de alguns materiais para aplicações elétricas ou eletrônicas é essencial para dissipar o calor que se produz por efeito Joule. A capacidade calorífica específica ou calor específico(Cp) é a quantidade de calor necessária para elevar, de um grau Celsius, a temperatura de um grama da substância a pressão constante. Abaixo estão apresentados a condutividade térmica e o calor específico de alguns materiais.

Julgue os itens abaixo como certo (C) ou errado (E)
( ) Parte do calor gerado pelo processador é transferido para o dissipador, por diferença de temperatura. Este, facilitado por sua alta condutividade térmica, transfere calor diretamente para o ambiente, ajudado pelo ar impulsionado pela ventoinha, que mantém, num processo contínuo, a estabilidade da temperatura, essencial para o funcionamento adequado do processador.
( ) Um dissipador feito de níquel tem melhor funcionalidade que um dissipador de cobre. No entanto, por questões econômicas, a maioria dos dissipadores são feitos de alumínio ou cobre.
( ) Em épocas frias é aconselhável usar roupas de tecidos de alta condutividade térmica, para evitar a hipotermia (diminuição da temperatura corporal abaixo de 35°C).
( ) A folha de alumínio confeccionada de forma fina utilizada na culinária tem as vantagens de economia de material e de segurança, pois a reduzida massa da folha nesse formato corresponde a uma quantidade de calor igualmente pequena que esta pode armazenar, o que evita riscos de queimaduras, por exemplo, no preparo de assados.
( ) As panelas de barro (material cerâmico artesanal) são mais eficientes para manter os alimentos quentes por um período de tempo maior que as panelas de alumínio, no entanto, são mais dispendiosas porque consomem maior quantidade de carvão para o preparo dos cozidos.
A seqüência correta é: