Questões de Vestibular USP 2009 para Vestibular - Prova 1
Foram encontradas 11 questões
Considere as seguintes afirmações:
I. O uso do logaritmo nas escalas mencionadas justifica- se pelas variações exponenciais das grandezas envolvidas.
II. A concentração de íons H+ de uma solução ácida com pH 4 é 10 mil vezes maior que a de uma solução alcalina com pH 8.
III. Um abalo sísmico de magnitude 6 na escala Richter libera duas vezes mais energia que outro, de magnitude 3.
Está correto o que se afirma somente em
]
Observe o esquema da Tabela Periódica, no qual estão destacados quatro elementos químicos, identificados pelas letras w, x, y e z.
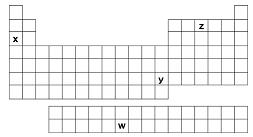
Considerando suas posições na Tabela Periódica, assinale a alternativa que melhor associa esses quatro elementos químicos com as propriedades discutidas acima.
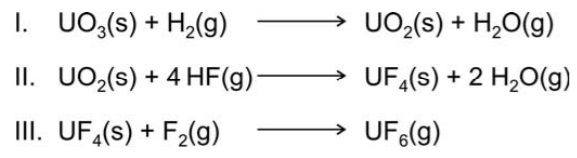
Sobre tais transformações, pode-se afirmar, corretamente, que ocorre oxirredução apenas em
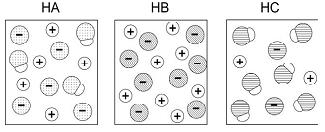
Considerando essas representações, foram feitas as seguintes afirmações sobre os ácidos:
I. HB é um ácido mais forte do que HA e HC.
II. Uma solução aquosa de HA deve apresentar maior condutibilidade elétrica do que uma solução aquosa de mesma concentração de HC.
III. Uma solução aquosa de HC deve apresentar pH maior do que uma solução aquosa de mesma concentração de HB.
Está correto o que se afirma em
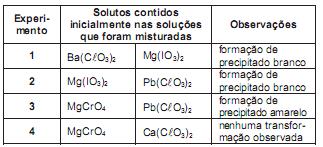
A partir desses experimentos, conclui-se que são pouco solúveis em água somente os compostos

Após uma série de quatro experimentos, o estudante representou os dados obtidos em uma tabela:
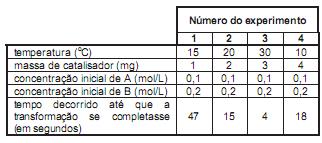
Que modificação deveria ser feita no procedimento para obter resultados experimentais mais adequados ao objetivo proposto?
2 Se + Sn -> SnSe2
Em um experimento, deseja-se que haja reação completa, isto é, que os dois reagentes sejam totalmente consumidos. Sabendo-se que a massa molar do selênio (Se) é 2/3 da massa molar do estanho (Sn), a razão entre a massa de selênio e a massa de estanho (mSe : mSn), na reação, deve ser de
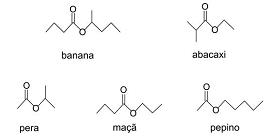
Analisando a fórmula estrutural dos ésteres apresentados, pode-se dizer que, dentre eles, os que têm cheiro de
Considere as seguintes transformações, representadas por equações químicas, em que, quando houver subprodutos, eles não estão indicados.
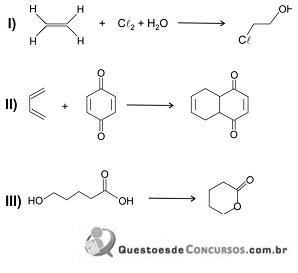
A ordem dessas transformações, da pior para a melhor, de acordo com a “Química Verde”, é:
C6H4(OH)2(aq) + H2O2(aq)
 C6H4O2(aq) + 2 H2O(
C6H4O2(aq) + 2 H2O( ) hidroquinona
) hidroquinonaO calor envolvido nessa transformação pode ser calculado, considerando-se os processos:
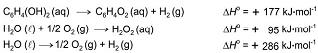
Assim sendo, o calor envolvido na reação que ocorre no organismo do besouro é
I. Transplantada para um solo cujo pH era 5,6 , uma planta com flores rosadas passou a gerar flores azuis.
II. Ao adicionar um pouco de nitrato de sódio ao solo, em que estava a planta com flores azuis, a cor das flores permaneceu a mesma.
III. Ao adicionar calcário moído (CaCO3) ao solo, em que estava a planta com flores azuis, ela passou a gerar flores rosadas.
Considerando essas observações, o botânico pôde concluir que