Questões de Vestibular USP 2014 para Vestibular 1° fase - 2015
Foram encontradas 90 questões
A notícia “Satélite brasileiro cai na Terra após lançamento falhar”, veiculada pelo jornal O Estado de S. Paulo de 10/12/2013, relata que o satélite CBERS-3, desenvolvido em parceria entre Brasil e China, foi lançado no espaço a uma altitude de 720 km (menor do que a planejada) e com uma velocidade abaixo da necessária para colocá-lo em órbita em torno da Terra. Para que o satélite pudesse ser colocado em órbita circular na altitude de 720 km, o módulo de sua velocidade (com direção tangente à órbita) deveria ser de, aproximadamente,
Note e adote:
raio da Terra = 6 x 103 km
massa da Terra = 6 x 1024 kg
constante de gravitação universal G = 6,7 x 10-11m3 / (s2 kg)
Em uma aula de laboratório de Física, para estudar propriedades de cargas elétricas, foi realizado um experimento em que pequenas esferas eletrizadas são injetadas na parte superior de uma câmara, em vácuo, onde há um campo elétrico uniforme na mesma direção e sentido da aceleração local da gravidade. Observou-se que, com campo elétrico de módulo igual a 2 x 103 V/m, uma das esferas, de massa 3,2 x 10-15 kg, permanecia com velocidade constante no interior da câmara. Essa esfera tem
Note e adote:
carga do elétron = -1,6 x 10-19 C c
arga do próton = + 1,6 x 10-19 C
aceleração local da gravidade = 10 m/s2
Certa quantidade de gás sofre três transformações sucessivas, A → B, B → C e C → A, conforme o diagrama p-V apresentado na figura abaixo.
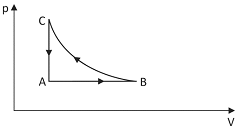
A respeito dessas transformações, afirmou-se o seguinte:
I. O trabalho total realizado no ciclo ABCA é nulo.
II. A energia interna do gás no estado C é maior que no estado A.
III. Durante a transformação A՜B, o gás recebe calor e realiza trabalho.
Está correto apenas o que se afirma em
Note e adote:
o gás deve ser tratado como ideal a transformação B →C é isotérmica.
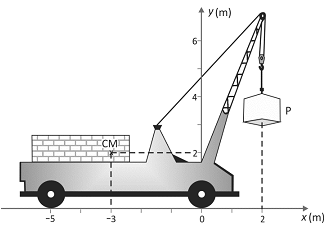
O guindaste da figura acima pesa 50.000 N sem carga e os pontos de apoio de suas rodas no solo horizontal estão em x = 0 e x = 5 m. O centro de massa (CM) do guindaste sem carga está localizado na posição (x = 3 m, y = 2 m). Na situação mostrada na figura, a maior carga P que esse guindaste pode levantar pesa
A figura abaixo mostra o gráfico da energia potencial gravitacional U de uma esfera em uma pista, em função da componente horizontal x da posição da esfera na pista.
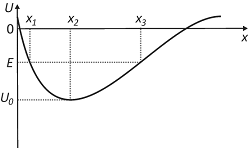
A esfera é colocada em repouso na pista, na posição de abscissa x = x1, tendo energia mecânica E < 0. A partir dessa condição, sua energia cinética tem valor
Note e adote:
desconsidere efeitos dissipativos.
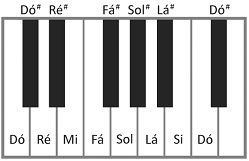
A figura acima mostra parte do teclado de um piano. Os valores das frequências das notas sucessivas, incluindo os sustenidos, representados pelo símbolo #, obedecem a uma progressão geométrica crescente da esquerda para a direita; a razão entre as frequências de duas notas Dó consecutivas vale 2; a frequência da nota Lá do teclado da figura é 440 Hz. O comprimento de onda, no ar, da nota Sol indicada na figura é próximo de
Note e adote:
21/12 = 1,059
(1,059)2 = 1,12
velocidade do som no ar = 340 m/s
Quando começaram a ser produzidos em larga escala, em meados do século XX, objetos de plástico eram considerados substitutos de qualidade inferior para objetos feitos de outros materiais. Com o tempo, essa concepção mudou bastante. Por exemplo, canecas eram feitas de folha de flandres, uma liga metálica, mas, hoje, também são feitas de louça ou de plástico. Esses materiais podem apresentar vantagens e desvantagens para sua utilização em canecas, como as listadas a seguir:
I. ter boa resistência a impactos, mas não poder ser levado diretamente ao fogo;
II. poder ser levado diretamente ao fogo, mas estar sujeito a corrosão;
III. apresentar pouca reatividade química, mas ter pouca resistência a impactos.
Os materiais utilizados na confecção de canecas os quais
apresentam as propriedades I, II e III são, respectivamente,
Cinco cremes dentais de diferentes marcas têm os mesmos componentes em suas formulações, diferindo, apenas, na porcentagem de água contida em cada um. A tabela a seguir apresenta massas e respectivos volumes (medidos a 25 °C) desses cremes dentais.
Marca de Massa Volume
creme dental (g) (mL)
A 30 20
B 60 42
C 90 75
D 120 80
E 180 120
Supondo que a densidade desses cremes dentais varie
apenas em função da porcentagem de água, em massa,
contida em cada um, pode-se dizer que a marca que
apresenta maior porcentagem de água em sua composição
é
Dado: densidade da água (a 25 °C) = 1,0 g / mL.
Considere as figuras a seguir, em que cada esfera representa um átomo.
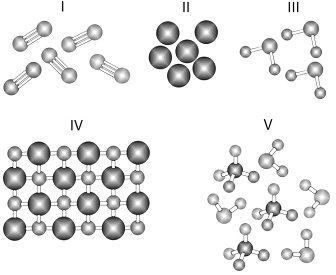
As figuras mais adequadas para representar,
respectivamente, uma mistura de compostos moleculares e
uma amostra da substância nitrogênio são
A Gruta do Lago Azul (MS), uma caverna composta por um lago e várias salas, em que se encontram espeleotemas de origem carbonática (estalactites e estalagmites), é uma importante atração turística. O número de visitantes, entretanto, é controlado, não ultrapassando 300 por dia. Um estudante, ao tentar explicar tal restrição, levantou as seguintes hipóteses:
I. Os detritos deixados indevidamente pelos visitantes se decompõem, liberando metano, que pode oxidar os espeleotemas.
II. O aumento da concentração de gás carbônico que é liberado na respiração dos visitantes, e que interage com a água do ambiente, pode provocar a dissolução progressiva dos espeleotemas.
III. A concentração de oxigênio no ar diminui nos períodos de visita, e essa diminuição seria compensada pela liberação de O2 pelos espeleotemas.
O controle do número de visitantes, do ponto de vista da
Química, é explicado por
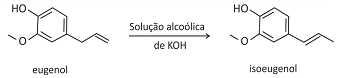
O eugenol, extraído de plantas, pode ser transformado em seu isômero isoeugenol, muito utilizado na indústria de perfumes. A transformação pode ser feita em solução alcoólica de KOH.
Foram feitos três experimentos de isomerização, à mesma temperatura, empregando-se massas iguais de eugenol e volumes iguais de soluções alcoólicas de KOH de diferentes concentrações. O gráfico a seguir mostra a porcentagem de conversão do eugenol em isoeugenol em função do tempo, para cada experimento.
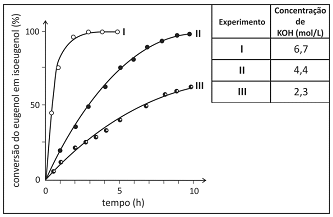
Analisando-se o gráfico, pode-se concluir corretamente que
Um estudante utilizou um programa de computador para testar seus conhecimentos sobre concentração de soluções. No programa de simulação, ele deveria escolher um soluto para dissolver em água, a quantidade desse soluto, em mol, e o volume da solução. Uma vez escolhidos os valores desses parâmetros, o programa apresenta, em um mostrador, a concentração da solução. A tela inicial do simulador é mostrada a seguir.
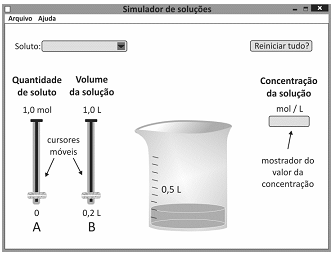
O estudante escolheu um soluto e moveu os cursores A e B
até que o mostrador de concentração indicasse o valor
0,50 mol/L. Quando esse valor foi atingido, os cursores A e
B poderiam estar como mostrado em
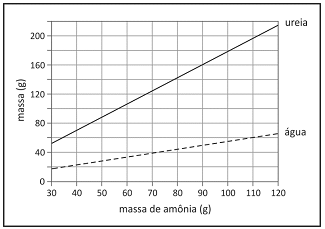
Amônia e gás carbônico podem reagir formando ureia e água. O gráfico ao lado mostra as massas de ureia e de água que são produzidas em função da massa de amônia, considerando as reações completas.
A partir dos dados do gráfico e dispondo-se de 270 g de amônia, a massa aproximada, em gramas, de gás carbônico minimamente necessária para reação completa com essa quantidade de amônia é
O 1,4-pentanodiol pode sofrer reação de oxidação em condições controladas, com formação de um aldeído A, mantendo o número de átomos de carbono da cadeia.
O composto A formado pode, em certas condições, sofrer reação de descarbonilação, isto é, cada uma de suas moléculas perde CO, formando o composto B. O esquema a seguir representa essa sequência de reações:
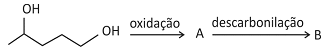
Os produtos A e B dessas reações são:
Uma estudante de Química realizou o seguinte experimento: pesou um tubo de ensaio vazio, colocou nele um pouco de NaHCO3 (s) e pesou novamente. Em seguida,adicionou ao tubo de ensaio excesso de solução aquosa de HCl, o que provocou a reação química representada por
NaHCO3(S) + HCl(aq) → NaCl(aq) + CO2(g) +H2O(l)
Após a reação ter-se completado, a estudante aqueceu o sistema cuidadosamente, até que restasse apenas um sólido seco no tubo de ensaio. Deixou o sistema resfriar até a temperatura ambiente e o pesou novamente. A estudante anotou os resultados desse experimento em seu caderno, juntamente com dados obtidos consultando um manual de Química:

A estudante desejava determinar a massa de
I. HCl que não reagiu;
II. NaCl que se formou;
III. CO2 que se formou.
Considerando as anotações feitas pela estudante, é possível
determinar a massa de
Soluções aquosas de ácido clorídrico, HCl (aq), e de ácido acético, H3CCOOH (aq), ambas de concentração 0,10 mol/L, apresentam valores de pH iguais a 1,0 e 2,9, respectivamente.
Em experimentos separados, volumes iguais de cada uma dessas soluções foram titulados com uma solução aquosa de hidróxido de sódio, NaOH (aq), de concentração adequada. Nessas titulações, a solução de NaOH foi adicionada lentamente ao recipiente contendo a solução ácida, até reação completa. Sejam V1 o volume da solução de NaOH para reação completa com a solução de HCl e V2 o volume da solução de NaOH para reação completa com a solução de H3CCOOH. A relação entre V1 e V2 é
Parte do solo da bacia amazônica é naturalmente pobre em nutrientes e, consequentemente, pouco apropriada para a agricultura comercial. Por outro lado, em certas porções desse território, são encontradas extensões de terra rica em carvão e nutrientes (sob a forma de compostos de fósforo e cálcio), os quais não resultaram da decomposição microbiana da vegetação. Esse tipo de solo é popularmente chamado de “terra preta”.
Dentre as hipóteses a seguir, formuladas para explicar a ocorrência da “terra preta”, a mais plausível seria a da
A ardência provocada pela pimenta dedoͲdeͲmoça é resultado da interação da substância capsaicina com receptores localizados na língua, desencadeando impulsos nervosos que se propagam até o cérebro, o qual interpreta esses impulsos na forma de sensação de ardência. Esse tipo de pimenta tem, entre outros efeitos, o de estimular a sudorese no organismo humano.
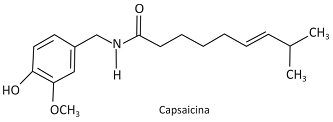
Considere as seguintes afirmações:
I. Nas sinapses, a propagação dos impulsos nervosos, desencadeados pelo consumo dessa pimenta, se dá pela ação de neurotransmissores.
II. Ao consumir essa pimenta, uma pessoa pode sentir mais calor pois, para evaporar, o suor libera calor para o corpo.
III. A hidrólise ácida da ligação amídica da capsaicina produz um aminoácido que é transportado até o cérebro, provocando a sensação de ardência.
É correto apenas o que se afirma em