Questões de Vestibular UFPR 2011 para Vestibular, Francês
Foram encontradas 9 questões
Na versão moderna da tabela periódica dos elementos, estes são organizados em grupos e períodos. A posição de cada elemento na tabela deve-se à sua estrutura eletrônica e, como resultado, as propriedades químicas ao longo de um grupo são bastante similares.
A seguir são fornecidas informações sobre as propriedades químicas, além da ocorrência natural, relacionadas a elementos representativos. Quanto a isso, numere a coluna da direita de acordo com sua correspondência com a da esquerda.
1. Encontrado na natureza em rochas e minerais argilosos. Possui quatro elétrons na camada de valência. O produto da reação da substância pura com oxigênio produz um sólido insolúvel, cuja temperatura de fusão é ~1700 °C.
2. Produzido industrialmente pelo resfriamento do ar. Sua substância pura é bastante inerte em função da tripla ligação que une os átomos.
3. Encontrado em minerais que ocorrem em áreas vulcânicas, sendo o mineral primário a ulexita. É largamente utilizado na fabricação de vidros.
4. Não é encontrado na natureza na forma elementar, mas somente combinado com outros elementos. Ocorre na crosta terrestre na forma de rochas. Tanto sua substância pura quanto seu hidreto apresentam-se como moléculas binárias contendo uma única ligação simples. Em condição ambiente, ambos são gases corrosivos.
5. Ocorre na natureza principalmente na forma combinada em rochas, sendo a pirita uma das principais fontes comerciais. No entanto, o gás natural e o xisto também são fontes naturais desse elemento. Ocorre na natureza em pelo menos 5 estados de oxidação, que são: -2, -1, 0, +4 e +6.
( ) Boro.
( ) Silício.
( ) Flúor.
( ) Nitrogênio.
( ) Enxofre.
Assinale a alternativa que apresenta a numeração correta na coluna da direita, de cima para baixo.
A maioria dos elementos da tabela periódica apresenta-se como metais quando cristalizados na sua substância pura. Suas propriedades químicas são alvos tanto da pesquisa quanto da aplicação industrial. Por pertencerem a uma mesma classe, os metais possuem características similares. Sobre as características dos metais, considere as seguintes afirmativas:
1. Metais apresentam alta condutividade térmica e elétrica.
2. Metais possuem altos valores de eletronegatividade.
3. Metais apresentam baixa energia de ionização.
4. Metais reagem espontaneamente com oxigênio.
Assinale a alternativa correta.
O dióxido de carbono é produto da respiração, da queima de combustíveis e é responsável pelo efeito estufa. Em condições ambiente, apresenta-se como gás, mas pode ser solidificado por resfriamento, sendo conhecido nesse caso como gelo seco.
Acerca da estrutura de Lewis do dióxido de carbono, considere as afirmativas a seguir (se houver mais de uma estrutura de Lewis possível, considere a que apresenta mais baixa carga formal dos átomos, isto é, a mais estável segundo o modelo de Lewis):
1. Entre o átomo de carbono e os dois oxigênios há duplas ligações.
2. O NOX de cada átomo de oxigênio é igual a -2.
3. O NOX do carbono é igual a zero.
4. O átomo de carbono não possui elétrons desemparelhados.
Assinale a alternativa correta.
Boiar no Mar Morto: luxo sem igual
É no ponto mais baixo da Terra que a Jordânia guarda seu maior segredo: o Mar Morto. Boiar nas águas salgadas do lago formado numa depressão, a 400 metros abaixo do nível do mar, é a experiência mais inusitada e necessária dessa jornada, mas pode estar com os anos contados. A superfície do Mar Morto tem encolhido cerca de 1 metro por ano e pode sumir completamente até 2050.
(Camila Anauate. O Estado de São Paulo. Disponível em <http://www.estadao. com.br/noticias/suplementos,boiar-no-mar-morto-luxo-sem-igual,175377,0.htm
A alta concentração salina altera uma propriedade da água pura, tornando fácil boiar no Mar Morto. Assinale a
alternativa correspondente a essa alteração.
A capsaicina é a substância responsável pelo sabor picante de várias espécies de pimenta. A capsaicina é produzida como metabólito e tem provável função de defesa contra herbívoros. A estrutura química da capsaicina está indicada a seguir:
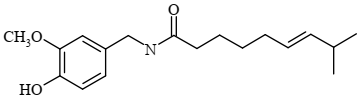
Assinale a alternativa que apresenta as funções orgânicas presentes nessa molécula.
Com o desenvolvimento da fotografia nos séculos XIX e XX, muitos estudos investigaram a química dos haletos de prata. Com isso, além do desenvolvimento tecnológico, avanços científicos foram alcançados no entendimento da formação de cristais e reações fotoquímicas envolvendo compostos iônicos. Na tabela a seguir são fornecidos dados de propriedades, como produto de solubilidade e de potencial padrão de redução, dos principais haletos de prata.
KPS (mol2 . dm-6) E0 (V)
AgX + e- → Ag0 + X-
AgCℓ 1,77 x 10-10 0,22233
AgBr 5,35 x 10-13 0,07133
Agl 8,52 x 10-17 -0,15224
Com relação aos haletos de prata, identifique as afirmativas a seguir como verdadeiras (V) ou falsas (F):
( ) O cátion Ag+ possui maior afinidade por haletos de mais baixa razão carga:raio.
( ) Existe uma tendência clara: quanto menos solúvel é o haleto de prata, menos oxidante esse composto será.
( ) Numa amostra composta por uma mistura de cloreto, brometo e iodeto de prata, e um forte agente redutor, a primeira espécie a reduzir será o Agl.
( ) Ao se adicionar 1 mol de um haleto de prata sólido (representação genérica: AgX) numa solução aquosa 1,0 mol.dm-3 do respectivo haleto de potássio (representação genérica: KX), a máxima quantidade de íons prata em solução será inferior a ppb (partes por bilhão).
Assinale a alternativa que apresenta a sequência correta, de cima para baixo.
A utilização de sabões para limpeza data de mais de 4000 anos. Os sabões são constituídos de moléculas anfifílicas, que contêm uma porção hidrofóbica e uma hidrofílica, e consequentemente atuam como tensoativos. Além da ação física do sabão no processo de remoção de sujeiras, há também a ação química, em que ocorre reação entre as moléculas anfifílicas e a sujeira, principalmente gorduras. Mesmo sem conhecimento científico, muitas pessoas constatam que a lavagem com sabão utilizando água quente é mais eficiente que com água fria. Com relação à ação dos sabões, considere as seguintes afirmativas:
1. A velocidade de remoção de sujeiras (à base de gorduras) de uma roupa é aumentada em altas temperaturas, pois nessa condição há maior frequência de choques entre as moléculas.
2. O processo de solubilização da sujeira envolve interação entre a parte hidrofóbica do tensoativo e a gordura, deixando a parte hidrofílica exposta na superfície que interage com o solvente.
3. A maior eficiência de lavagem em temperaturas mais altas implica que a reação entre o tensoativo e a sujeira é um processo endotérmico.
4. Em temperaturas superiores à temperatura de fusão de gorduras da sujeira, a velocidade de remoção é aumentada, em função da maior superfície de contato.
Assinale a alternativa correta.
Os principais componentes dos óleos e gorduras são os triacilgliceróis, moléculas formadas a partir do glicerol e dos ácidos graxos, que podem ser saturados ou insaturados. Uma simbologia usual que representa os ácidos graxos se baseia em um sistema alfanumérico iniciado pela letra C, seguido pelo número de átomos de carbono na molécula e o número de ligações duplas entre átomos de carbono. As posições das insaturações na cadeia carbônica são indicadas em seguida após o símbolo ∆.
Ácidos graxos podem ser sólidos ou líquidos em temperatura ambiente e sua temperatura de fusão depende da estrutura e composição da cadeia carbônica. Numere a coluna da direita (em que são indicadas temperaturas de fusão) de acordo com sua correspondência com a da esquerda.
1. Ácido oleico = C18:1–∆ 9.
2. Ácido linoleico = C18:2–∆ 9,12.
3. Ácido linolênico = C18:3–∆ 9,12,15.
4. Ácido araquidônico = C20:4–∆ 5,8,11,14.
5. Ácido láurico = C12:0.
( ) +44 °C.
( ) - 50 °C.
( ) +14 °C.
( ) - 11 °C.
( ) - 5 °C.
Assinale alternativa que apresenta a numeração correta na coluna da direita, de cima para baixo.
Em 2011 celebramos o Ano Internacional da Química. Além disso, 2011 é também o ano do centenário do recebimento do Prêmio Nobel de Química por Marie Curie, que foi a primeira cientista a receber dois Prêmios Nobel, o primeiro em 1903, em Física, devido às suas contribuições para as pesquisas em radioatividade, e o segundo em 1911, pela descoberta dos elementos rádio e polônio. O polônio não possui isótopos estáveis, todos são radioativos, dos quais apenas o 210Po ocorre naturalmente, sendo gerado por meio da série de decaimento do rádio. A seguir são ilustrados dois trechos da série de decaimento do rádio:
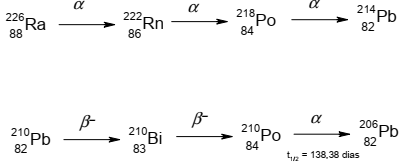
Com base nas informações fornecidas, considere as seguintes afirmativas:
1. A partícula α possui número de massa igual a 4.
2. Para converter 214Pb em 210Pb, conectando os dois trechos da série, basta a emissão de uma partícula α.
3. Uma amostra de 210Po será totalmente convertida em 206Pb após 276,76 dias.
4. No decaimento β − , o número de massa é conservado, pois um nêutron é convertido em um próton.
Assinale a alternativa correta.