Questões de Vestibular PUC - RJ 2014 para Vestibular , 2° Dia Prova Tarde grupo 5
Foram encontradas 30 questões
A um balão volumétrico de 250,00 mL foram adicionados 50,00 mL de solução aquosa de KMnO4 0,10 mol L-1 e 50,00 mL de solução aquosa de NaMnO4 0,20 mol L-1 .
A seguir avolumou-se com água destilada até a marca de referência 250,00 mL seguido de homogeneização da mistura. Levando em conta a dissociação iônica total dos sais no balão, a concentração da espécie iônica permanganato, em quantidade de matéria (mol L-1 ), é igual a:
Nas equações abaixo, representadas na forma simplificada, há espécies ionizadas (não mostradas nessa forma) que participam das reações enquanto outras não:
I. KCℓ(aq) + AgNo3(aq) -> AgCℓ(s) + KNO3(aq)
I. FeCℓ3(aq) + SnCℓ2(aq) -> FeCℓ2(aq) + SnCℓ4(aq)
III. Ba(OH)2(aq) + H2SO4(aq) -> BaSo4(s) + H20(ℓ)
Nessas equações, os símbolos (aq), (s) e (ℓ) representam, respectivamente, “espécies químicas dissolvidas em água”, “espécies químicas no estado sólido” e “espécies químicas no estado líquido”.
É correto afirmar que, na reação indicada, são íons espectadores
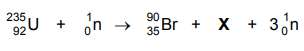
O produto X, formado na fissão nuclear indicada acima, é um isótopo do elemento químico:
Assumindo que uma amostra de gás oxigênio puro, encerrada em um frasco, se comporta idealmente, o valor mais próximo da densidade, em gL-1 , desse gás a 273 K e 1,0 atm é:
Considere: R = 0,082 atm L mol-1
K-1
M(O2) = 32 g mol-1
A um volume de 1,0 L de efluente industrial contendo íons Cu2+, adicionou-se excesso de sulfeto de amônio para precipitar todo o cobre dissolvido na amostra na forma de CuS. Ao se recolher o precipitado e secá-lo, constatou-se que a massa era 2,40 g. A concentração, em mol L-1 , que mais se aproxima da de Cu2+ no efluente é:
Considere: M(Cu) = 63,5 g mol-1
M(S) = 32 g mol-1
A seguir está representada a estrutura do ácido fumárico.
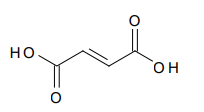
A respeito desse ácido, é correto afirmar que ele possui
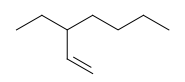
Segundo as regras da IUPAC, a nomenclatura do composto representado acima é
Considere as seguintes afirmações a respeito da acidez e da basicidade dos compostos orgânicos citados.
I. Metilamina (CH3 NH2 ) possui caráter básico, pois o par de elétrons livres do átomo de nitrogênio pode receber próton dando origem a uma ligação.
II. Metilamina (CH3 NH2 ) possui caráter básico, pois um dos átomos de hidrogênio ligados ao átomo de nitrogênio pode ser doado facilmente.
III. Fenol (C6 H5 OH) possui um caráter ácido fraco, mas ainda assim ele pode doar íon H+ quando reage, por exemplo, com uma base forte.
É correto APENAS o que se afirma em