Questões de Vestibular UCS 2015 para Vestibular - Química
Foram encontradas 10 questões
Disponível em:<http://info.abril.com.br/noticias/ciencia/2015/07mit-1.shtml> . Acesso em: 20 ago. 15. (Adaptado.)
Em relação ao nióbio, analise as proposições a seguir, quanto à sua veracidade (V) ou falsidade (F).
( ) O elemento químico nióbio é um metal de transição interna do quarto período da Tabela Periódica.
( ) Átomos de nióbio, no estado fundamental, apresentam 5 elétrons na camada de valência.
( ) O elétron de maior energia de um átomo de nióbio, no estado fundamental, encontra-se no subnível 4s.
( ) A liga ferro-nióbio é um exemplo de solução sólida, onde os átomos de ferro e de nióbio estão unidos entre si por meio de ligações metálicas.
Assinale a alternativa que preenche correta e respectivamente os parênteses, de cima para baixo.
PbCO3(s) + 2 HNO3(aq) ® Pb(NO3)2(aq) + H2O (ℓ) + CO2(g) (Equação 1)
Pb(NO3)2(aq) + H2SO4(aq) ® PbSO4(s) + 2 HNO3(aq) (Equação 2)
Supondo que uma amostra de 0,79 g do mineral tenha produzido 0,84 g de PbSO4, pode-se concluir que a porcentagem em massa de PbCO3 na amostra é, em valores arredondados, de
Temperatura (°C) Pressão máxima de vapor de água
no ar atmosférico (mm Hg)
10 9,2
20 17,5
30 31,8
40 55,3
A umidade relativa (UR) é um termo utilizado com frequência pelos meteorologistas para indicar a quantidade de vapor de água presente no ar atmosférico. Em uma mesma temperatura, a UR pode ser obtida pela razão entre a pressão parcial de vapor de água presente no ar e a pressão máxima de vapor de água. Assim, um local onde a temperatura encontra-se a 20 °C e a pressão parcial de vapor de água é igual a 10,5 mm Hg, terá uma UR, em termos percentuais, de
A equação química que descreve, simplificadamente, o processo de obtenção industrial do 1,2-dicloroetano, a partir da reação de adição de gás cloro ao eteno, encontra-se representada abaixo.
C2H4(g) + Cℓ2(g) ® C2H4Cℓ2(ℓ)
Disponível em:<http://laboratorios.cetesb.sp.gov.br/wp-content/uploads/sites/47/2013/11/dicloroetano.pdf>. Acesso em: 3 set. 15. (Adaptado.)
A variação de entalpia da reação acima é igual a
Dados:
Ligação Energia de ligação (kJ/mol)
C–H 413,4
C–Cℓ 327,2
C–C 346,8
C=C 614,2
Cℓ–Cℓ 242,6
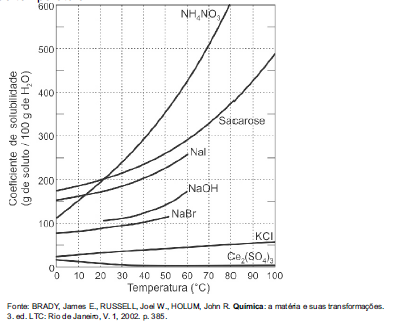
Considerando as informações apresentadas pelo gráfico acima, assinale a alternativa correta.
A titulação de 50 mL de uma solução aquosa de ácido clorídrico, com uma solução aquosa de hidróxido de sódio de concentração molar igual a 0,1 mol/L, utilizando fenolftaleína como indicador, está representada no gráfico a seguir.
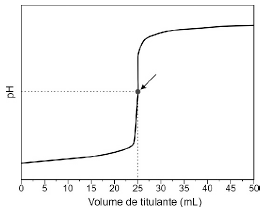
Considerando as informações do enunciado e do gráfico, assinale a alternativa correta.
Disponível em:<http://aspiraçoesquimicas.net/2014/08/feromonios-e-a-quimica-das-abelhas.html/> . Acesso em: 20 ago. 15. (Adaptado.)
Em relação às substâncias orgânicas mencionadas acima, assinale a alternativa correta.
Disponível em:<http:// www1.folha.uol.com.br/cotidiano/2015/08/1671619-quase-13-das-criancas-com menos-de 2-anos-bebem-refrigerante-aponta-ibge.shtml> . Acesso em: 20 ago. 15. (Adaptado.)
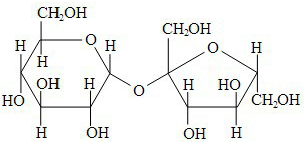
Em relação à sacarose, considere as proposições abaixo.
I É um açúcar redutor, de fórmula molecular C12H22O11, que não pode ser hidrolisado por soluções ácidas diluídas.
II É solúvel em água, devido ao rompimento da ligação entre as unidades de glicose e frutose.
III É um dissacarídeo, de caráter polar, e que apresenta na sua estrutura apenas átomos de carbono hibridizados na forma sp3 .
Das proposições acima,
Pouco depois de a bomba atômica ser lançada sobre o Japão, cientistas inventaram outra arma, ainda mais poderosa: a bomba de hidrogênio. Em 1957, a bomba H explodia no atol de Bikini, no Oceano Pacífico.Tinha um poder de destruição cinco vezes maior do que todas as bombas convencionais detonadas durante a Segunda Guerra Mundial.
Prevendo a corrida armamentista, Albert Einstein declarou em 1945: “O poder incontrolado do átomo mudou tudo, exceto nossa forma de pensar e, por isso, caminhamos para uma catástrofe sem paralelo".

Disponível em:<http://www.sitedecuriosidades.com/curiosidade/as-bombas-atomicas-lancadas-sobre-o-japao.html><http://www.nippo.com.br/4.hiroshima/>.<http://pt.wikipedia.org/wiki/Bombardeamentos de Hiroshima e Nagasaki>. Acesso em: 2 set. 15.
Em relação à temática e às informações apresentadas no texto, assinale a alternativa correta.