Questões de Vestibular UEFS 2010 para Vestibular, Prova 3
Foram encontradas 20 questões
Clorofórmio, CHCl3 -63 61 Etoxietano, CH3 CH2 OCH2 CH3 -116 34 Etanol, CH3 CH2 OH -117 78 Fenol, C6 H5 OH 41 182 Pentano, CH3 (CH2)3 CH3 -130 36
A partir da análise dos dados dessa tabela, que apresenta as propriedades físicas de algumas substâncias químicas, é correto afirmar:
A partir da concepção de Robert Boyle e do conceito moderno de elemento químico, é correto afirmar:
A partir da utilização desses modelos de ligação química na compreensão da estrutura molecular de algumas substâncias, é correto afirmar:
Propano, CH3CH2CH3 44 -42 Metoximetano, CH3OCH3 46 -25 Etanol, CH3CH2OH 46 78 Butano, CH3(CH2)2CH3 58 -1
As forças das interações intermoleculares são responsáveis por manter os estados de agregação nos líquidos e nos sólidos moleculares, além de influir sobre a diferença de temperatura de ebulição entre essas substâncias. Embora a intensidade das interações intermoleculares represente um fator preponderante, o tamanho da molécula também influi sobre a temperatura de ebulição dessas substâncias.
A tabela apresenta as massas moleculares e os pontos de ebulição de algumas substâncias moleculares.
A partir dessas informações e da análise desses dados da tabela, é correto afirmar:
Considerando-se essas informações, é correto afirmar:
O dihidrogenofosfato de sódio, NaH2PO4, é um conservante utilizado em alimentos.
Em relação a esse conservante, é correto afirmar:
Em três recipientes de volumes iguais e à mesma temperatura são colocados, respectivamente, 2,6kg de etino, C2H2(g), 1,6kg de oxigênio, O2(g), e 2,3kg de dióxido de nitrogênio, NO2(g).
Considerando-se essas informações e admitindo-se que esses gases são ideais, é correto concluir:
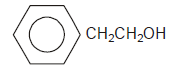
Determinada espécie de peixes, a exemplo dos salmões, é capaz de perceber a presença na água de 2-fenil-etanol, representado pela fórmula química, em concentrações muito pequenas, como a de 4,0g em 1,0.1014L.
A análise dessas informações permite afirmar:

O diagrama representa a entalpia de formação do pentacloreto de fósforo a partir de duas variedades alotrópicas de fósforo, o fósforo branco e o fósforo vermelho.
A partir da análise desse diagrama, é correto afirmar:
[ICI] (mol.L-1) [H2] (mol.L-1) Velocidade inicial (mol.L-1.s-1)
1,5 1,5 3,7 . 10-7
3,0 1,5 7,4 . 10-7
3,0 4,5 22 . 10-7
4,7 2,7 X
Os dados apresentados na tabela foram obtidos a partir de experimentos feitos com a reação de cloreto de iodo, ICl(g) e hidrogênio, H2(g), a determinada temperatura.
Uma análise desses dados permite inferir:
A presença de íons Fe3+(aq) é responsável pelas propriedades características de água ferruginosa de alguns rios.
Uma análise da presença de íons Fe3+(aq) nas águas ferruginosas de alguns rios permite concluir:
Os trabalhos do químico alemão Friedrich Willhelm Ostwald sobre a relação matemática entre constante de ionização, Ka, com o grau de ionização, α, e com a concentração em mol.L−1 , m, de um ácido fraco ficaram conhecidos como a Lei de diluição de Ostwald, representada pela expressão Ka= a2 .m/ 1 - α. As suas pesquisas levaram-no ao recebimento, em 1909, do prêmio Nobel de Química.
A partir dessas informações e da reação de ionização do ácido hipobromoso, em uma solução 0,1 molar desse ácido, representada pela equação química, é correto afirmar:
Um dado sistema em que inicialmente existem apenas reagentes pode convergir para um estado em que há reagentes e produtos coexistindo com concentrações constantes ao longo do tempo. Essas concentrações não se alteram em razão de as reações direta e inversa se processarem com velocidades iguais, o que caracteriza um estado de equilíbrio dinâmico.
De acordo com essas informações e considerando o sistema, representado pela equação química, formado inicialmente pela mistura de 1,0mol de Br2(g) com 1,0mol de H2(g), contida em um recipiente de 10,0L, a determinada temperatura, ao atingir o estado de equilíbrio, apresentou 0,20mol de HBr, é correto afirmar:
MnO-4(aq) + H+(aq) + H2O2((aq) → Mn2+(aq) + H2O(ℓ) + O2(g)
O peróxido de hidrogênio, H2O2(ℓ), é um líquido incolor espesso, empregado como antisséptico e alvejante, a depender da concentração. Ao reagir com algumas substâncias, o peróxido de hidrogênio pode atuar como oxidante ou redutor. A equação química não balanceada representa a reação do íon permanganato com o peróxido de hidrogênio.
A partir dessas informações e após o balanceamento dessa
equação química com os menores coeficientes
estequiométricos inteiros, é correto afirmar:
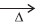 Na4P2O7(s) + 2CO2(g) + 2H2O(ℓ)
Na4P2O7(s) + 2CO2(g) + 2H2O(ℓ) A mistura de dihidrogeno-pirofosfato de sódio com hidrogenocarbonato de sódio, de acordo com a equação química, é utilizada como fermento químico na produção industrial de bolos, pães e biscoitos. Essa é uma forma rápida de fazer expandir, durante o aquecimento, a massa para o preparo desses alimentos, em relação à utilizada com fermento biológico.
Considerando-se essas informações, é correto afirmar:
A partir dessa informação, é correto afirmar:
A construção do Castelo Garcia D’Ávila esteve associada a uma série de problemas, entre os quais é correto destacar:
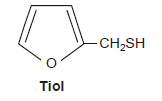
Em uma xícara de café recém-preparado, há dezenas de substâncias químicas diferentes. Uma dessas substâncias, que é formada durante a torrefação do grão de café, representada pela fórmula estrutural, é responsável pelo odor característico da bebida.
A partir da fórmula estrutural do tiol, é correto afirmar:
Esse processo produz inicialmente carboidratos menos complexos que a celulose, que, ao serem submetidos à fermentação, produzem etanol. O aproveitamento desses resíduos de biomassa aumenta em quase 100% a produção de etanol de cana-de-açúcar.
Uma análise dessas informações permite afirmar:
A partir dessas informações, é correto afirmar: