Questões de Vestibular UERJ 2014 para Vestibular, Segundo Exame - Francês
Foram encontradas 7 questões
Para fabricar um dispositivo condutor de eletricidade, uma empresa dispõe dos materiais apresentados na tabela abaixo:
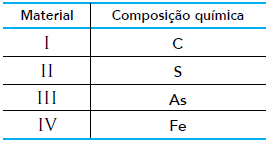
Sabe-se que a condutividade elétrica de um sólido depende do tipo de ligação interatômica existente em sua estrutura. Nos átomos que realizam ligação metálica, os elétrons livres são os responsáveis por essa propriedade.
Assim, o material mais eficiente para a fabricação do dispositivo é representado pelo seguinte
número:
Na pele dos hipopótamos, encontra-se um tipo de protetor solar natural que contém os ácidos hipossudórico e nor-hipossudórico. O ácido hipossudórico possui ação protetora mais eficaz, devido à maior quantidade de um determinado grupamento presente em sua molécula, quando comparado com o ácido nor-hipossudórico, como se observa nas representações estruturais a seguir.
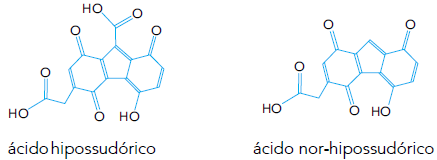
O grupamento responsável pelo efeito protetor mais eficaz é denominado:
Considere um corpo sólido de volume V. Ao flutuar em água, o volume de sua parte submersa é igual a V/8 ; quando colocado em óleo, esse volume passa a valer V/6.
Com base nessas informações, conclui-se que a razão entre a densidade do óleo e a da água corresponde a:
A decomposição térmica do carbonato de cálcio tem como produtos o óxido de cálcio e o dióxido de carbono. Na tabela a seguir, estão relacionados os períodos de quatro elementos químicos do grupo 2 da tabela de classificação periódica e a entalpia-padrão de decomposição do carbonato correspondente a cada um desses elementos.
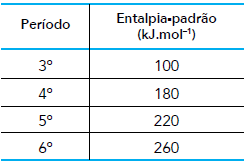
A energia, em quilojoules, necessária para a obtenção de 280 g de óxido de cálcio a partir de
seu respectivo carbonato é igual a:
A massa da mistura, em gramas, corresponde a:
O craqueamento é uma reação química empregada industrialmente para a obtenção de moléculas mais leves a partir de moléculas mais pesadas. Considere a equação termoquímica abaixo, que representa o processo utilizado em uma unidade industrial para o craqueamento de hexano.
H3C − CH2 − CH2 − CH2 − CH2 − CH3 (g) ⇌ H3C − CH2 − CH2 − CH3(g) + H2C = CH2 (g) ∆H >0
Em um experimento para avaliar a eficiência desse processo, a reação química foi iniciada sob temperatura T1 e pressão P1 . Após seis horas, a temperatura foi elevada para T2 , mantendo-se a pressão em P1 . Finalmente, após doze horas, a pressão foi elevada para P2 , e a temperatura foi mantida em T2 .
A variação da concentração de hexano no meio reacional ao longo do experimento está
representada em:
Em um experimento, os tubos I, II, III e IV, cujas aberturas estão totalmente vedadas, são iluminados por luzes de mesma potência, durante o mesmo intervalo de tempo, mas com cores diferentes. Além da mesma solução aquosa, cada tubo possui os seguintes conteúdos:
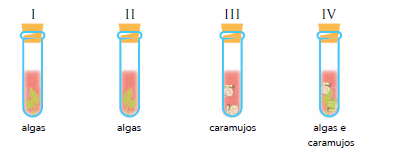
A solução aquosa presente nos quatro tubos tem, inicialmente, cor vermelha. Observe, na escala abaixo, a relação entre a cor da solução e a concentração de dióxido de carbono no tubo.
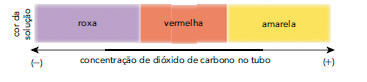
Os tubos I e III são iluminados por luz amarela, e os tubos II e IV por luz azul. Admita que a espécie de alga utilizada no experimento apresente um único pigmento fotossintetizante. O gráfico a seguir relaciona a taxa de fotossíntese desse pigmento em função dos comprimentos de onda da luz.
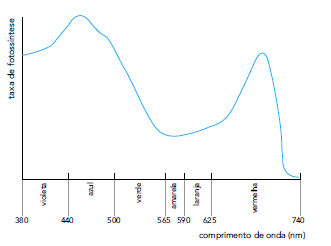
Após o experimento, o tubo no qual a cor da solução se modificou mais rapidamente de vermelha
para roxa é o representado pelo seguinte número: