Questões de Vestibular UERJ 2018 para Vestibular - Segundo Exame
Foram encontradas 7 questões
Em seu ciclo, um átomo de carbono pode ser incorporado a diferentes compostos por meio de processos contínuos de decomposição e formação de novas moléculas. Os átomos de carbono deste caderno de prova, por exemplo, serão degradados ao longo do tempo e, posteriormente, incorporados a outros seres vivos.
Considere que, ao se degradarem, os átomos de carbono deste caderno se distribuam igualmente entre os 7,5 bilhões de habitantes do planeta.
Sabendo que o caderno possui 90 g de massa, com 45% de carbono em sua composição, o número de átomos que será incorporado em cada habitante é igual a:
A lactose é hidrolisada no leite “sem lactose”, formando dois carboidratos, conforme a equação química:
lactose + água → glicose + galactose
Se apenas os carboidratos forem considerados, o valor calórico de 1 litro tanto do leite integral quanto do leite “sem lactose” é igual a −90 kcal, que corresponde à entalpia-padrão de combustão de 1 mol de lactose.
Assumindo que as entalpias-padrão de combustão da glicose e da galactose são iguais, a entalpia de combustão da glicose, em kcal/mol, é igual a:
Considere as informações a seguir sobre a perfluorodecalina, substância utilizada no preparo de sangue artificial.
Fórmula mínima: C5 F9 .
Massa molar: 462 g/mol.
Sua fórmula molecular é representada por:
A tabela abaixo apresenta a composição química de uma amostra de 500 g de vidro borossilicato.
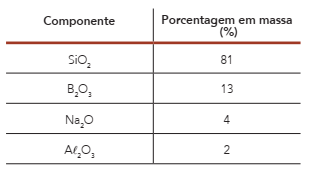
Um canudo de plástico e outro de vidro borossilicato possuem mesmo volume e densidades de 0,90 g/cm3 e 2,25 g/cm3 , respectivamente.
A razão entre as massas do canudo de plástico e do canudo de vidro corresponde a:

