Questões de Vestibular UFBA 2013 para Vestibular de Zootecnia
Foram encontradas 13 questões
O aminoácido arginina pertence ao grupo cujas cadeias laterais são ácidas em pH=7,0 devido à presença de mais um grupo carboxílico na molécula, além daquele ligado ao carbono α.
Os aminoácidos, quando dissolvidos em solução aquosa, dependendo do pH dessa solução, podem ter carga líquida positiva, negativa ou nula, sendo essa propriedade utilizada para separá-los por eletroforese.
O ácido aspártico, contendo cinco átomos de carbono na cadeia principal, é um aminoácido que recebe essa denominação por apresentar um caráter ácido em pH=7,0 devido à presença de um grupamento carboxila extra ligado ao átomo de carbono α da molécula.
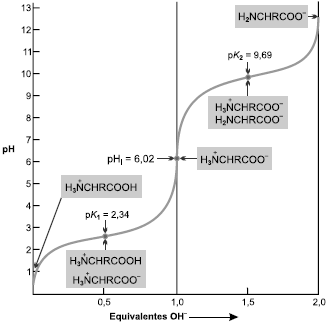
Com base na análise dessa figura, pode-se afirmar:
A alanina apresenta uma curva de titulação de ácido monoprótico, já que, à medida que se adiciona base à solução, o grupamento carboxila se dissocia, gerando uma molécula com carga líquida igual a zero até que seja atingido o pH=2,34.

Com base na análise dessa figura, pode-se afirmar:
A alanina, em pH=6,02, é eletricamente neutra; esse valor de pH é denominado de ponto isoelétrico e pode ser calculado para qualquer um dos vinte aminoácidos padrão através da média entre os valores de pK dos grupos α-amino e α-carboxílico do aminoácido.
Quando os aminoácidos glicina (pKαCOOH =2,34; pKαNH2 =9,60) e histidina (pKαCOOH =1,82; pKαNH2 =9,17; pKR =6,0) são submetidos a eletroforese em pH=7,6, o primeiro migrará para o polo negativo e o último migrará para o polo positivo.
A região da molécula enzimática, na qual ocorre a ligação ao substrato, é denominada sítio ou centro ativo e tem especificidade pelo substrato, a ponto de diferenciar moléculas muito semelhantes, como os anômeros α e β da D-Glicose.
As enzimas podem ser classificadas de acordo com o tipo de reação química da qual participam, como as liases que catalisam a adição de grupos a duplas ligações ou formação de duplas ligações por meio de remoção de grupos.
Algumas enzimas, para que possam catalisar uma reação química, necessitam da ação conjunta de coenzimas, geralmente derivadas das vitaminas que vão ser oxidadas ou reduzidas durante a transformação do substrato em produto.
Uma enzima que necessita de coenzima para sua atuação catalítica é denominada de holoenzima quando está livre da associação, e de apoenzima quando está associada.
Na inibição enzimática reversível, ocorre, normalmente, quebra ou formação de ligações covalentes, de forma que a enzima original não pode ser regenerada.
A ligação glicosídica é formada quando um grupo hidroxila de um monossacarídeo reage com o carbono anomérico de outro monossacarídeo, originando um hemiacetal ou hemicetal a partir de um acetal ou cetal.
Após a ciclização da D-glicose, que ocorre através de reação entre o grupo aldeído do C-1 e da hidroxila ligada ao C-5 (assimétrico ou quiral), são formados dois estereoisômeros anômeros: a α-D-Glicose e a β-D-Glicose, que podem ser interconvertidos por meio da mutarrotação.