Questões de Vestibular
Foram encontradas 874 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Os modelos atômicos que conhecemos ajudam a explicar melhor a estrutura dos átomos, desde as ligações entre átomos até a previsão de comportamento de moléculas mais complexas como o DNA. Ao longo da história, vários modelos foram criados na tentativa de explicar melhor a natureza da matéria e sua constituição.
ALMEIDA, W. B. e Santos, H. F. Adaptado de Cadernos Temáticos de Química Nova na Escola, Modelos Teóricos para a compreensão da Estrutura da Matéria, n. 4, mai. 2001.
Dadas as seguintes afirmativas com respeito à evolução histórica do surgimento dos modelos atômicos,
I. A primeira concepção de modelo atômico considerava o átomo como uma partícula maciça e indivisível que comporia todas as substâncias, sendo idealizada por Dalton.
II. Com a descoberta dos elétrons e prótons, o modelo atômico de Dalton caiu por terra, visto que o átomo continha outras partículas e, portanto, não seria indivisível, conforme previa a teoria de Dalton.
III. Com a descoberta do núcleo, por Rutherford, observou-se que o modelo atômico proposto por J. J. Thomson possuía coerência e, portanto, concordava com os resultados experimentais.
IV. O atual modelo atômico leva em consideração os argumentos da teoria quântica, principalmente a quantização de energia que foi desenvolvida pelo físico alemão Max Planck no final de 1900.
V. O modelo atômico de Sammerfild propôs que as órbitas dos elétrons em torno do núcleo seriam órbitas circulares ao invés de órbitas elípticas, conforme previa a teoria proposta por Niels Bohr.
assinale a alternativa que contém a sequência com todas as afirmativas corretas.
Dois balões idênticos são confeccionados com o mesmo material e apresentam volumes iguais. As massas de seus respectivos conteúdos, gás hélio e gás metano, também são iguais. Quando os balões são soltos, eles alcançam, com temperaturas internas idênticas, a mesma altura na atmosfera.
Admitindo-se comportamento ideal para os dois gases, a razão entre a pressão no interior do balão contendo hélio e a do balão contendo metano é igual a:
Em um reservatório contendo água com pH igual a 7, houve um descarte acidental de ácido sulfúrico. Em seguida, foi adicionada uma determinada substância de caráter básico, em quantidade suficiente para neutralizar a acidez.
O gráfico que representa o comportamento do pH durante esse processo é:
A descoberta dos isótopos foi de grande importância para o conhecimento da estrutura atômica da matéria.
Sabe-se, hoje, que os isótopos 54Fe e 56Fe têm, respectivamente, 28 e 30 nêutrons.
A razão entre as cargas elétricas dos núcleos dos isótopos 54Fe e 56Fe é igual a:
Em uma das primeiras classificações periódicas, os elementos químicos eram organizados em grupos
de três, denominados tríades. Os elementos de cada tríade apresentam propriedades químicas
semelhantes, e a massa atômica do elemento central equivale aproximadamente à média aritmética
das massas atômicas dos outros dois. Observe as tríades a seguir:
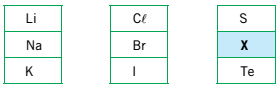
Com base nos critérios desta classificação, a letra X corresponde ao seguinte elemento químico: