Questões de Vestibular Comentadas por alunos sobre cinética química em química
Foram encontradas 119 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Considere as seguintes afirmações sobre velocidade das reações químicas:
I. ela é proporcional à temperatura.
II. ela não depende da concentração dos reagentes.
III. ela é afetada pela presença de um catalisador.
A afirmação está INCORRETA em:
A figura ilustra a cinética de uma reação química com e sem a presença de catalisador.
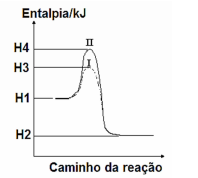
Numere a segunda coluna de acordo com a primeira coluna e, a seguir, assinale a sequência CORRETA encontrada.
1. H1 ( ) Energia liberada pela reação
2. H2 ( ) Energia de ativação da reação catalisada
3. H2-H1 ( ) Energia de ativação da reação não catalisada
4. H3-H1 ( ) Energia dos produtos
5. H4-H1 ( ) Energia dos reagentes
Considerando a reação de decomposição do peróxido de hidrogênio e o gráfico representado abaixo, avalie as afirmativas apresentadas abaixo e assinale a alternativa CORRETA.
I. A curva em verde representa o consumo de peróxido de hidrogênio. II. A curva em azul representa a produção de oxigênio. III. A velocidade média de decomposição da água oxigenada pode ser representada por: -Δ[H2O2]/ Δt
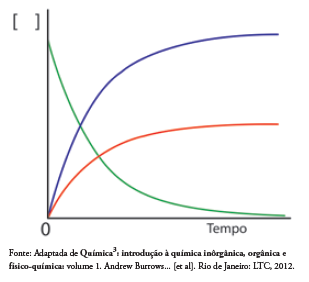
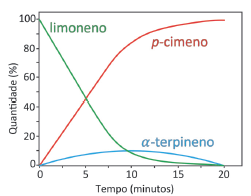
Uma representação adequada para esse processo é:
Sob determinadas condições, verificou-se que a taxa de produção de oxigênio na reação abaixo é de 8,5 x 10 –5 mol L –1 s –1.
N2O5(g) → N2O4(g) + 1/2 O2(g)
Se a velocidade permanecer constante, ao longo de 5 minutos, a diminuição da concentração de N2O5 será de