Questões de Vestibular
Foram encontradas 574 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
I. Um catalisador aumenta o rendimento de uma reação. II. No momento em que ocorre o choque entre as partículas em uma posição favorável, forma-se uma estrutura intermediária entre os reagentes e os produtos denominada complexo ativado. III.O valor da energia de ativação é independente da presença de catalisador.
Está(ão) correta(s) a(s) afirmativa(s)
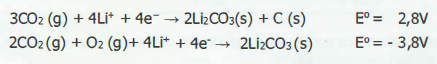
Sobre essas baterias, é correto afirmar que
Uma possibilidade de realização dessa reação usa persulfato, tiossulfato e iodeto, e, nesse caso, uma das etapas é a reação entre o íon persulfato (S2O8 2 -) e o íon iodeto (I-), cuja velocidade de decomposição do persulfato foi determinada e encontra-se na tabela abaixo.
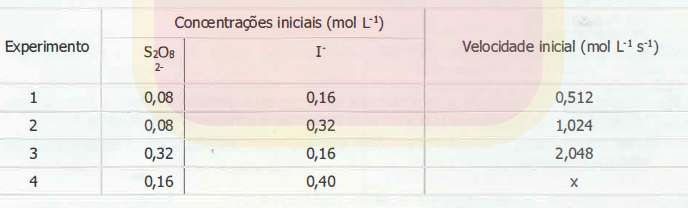
Assinale a alternativa que apresenta a velocidade inicial x do experimento 4, em mol L-1 s-1, tendo em vista as condições expressas acima.
2 C (s) + 3 H2 (g) + ½ 02 (g) --+ C2HsOH (1)
Embora essa reação, tal como está escrita, não possa ser realizada em laboratório, pode-se calcular seu efeito térmico, mediante uma combinação adequada de outras reações.
Usando as reações abaixo,
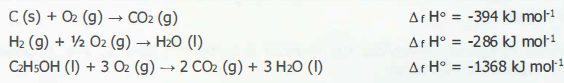
a entalpia da reação de formação do etanol, em kJ mo1-1 , é
4Ag(s) + 2H2S(g) + O2(g)
 2Ag2S(s) + 2H2O(l)
2Ag2S(s) + 2H2O(l)
Nesse processo, o agente redutor é
