Questões de Vestibular
Foram encontradas 863 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
I. trata-se de uma água alcalina. II. há elevada concentração de íons trivalentes, devido à presença do cálcio. III. trata-se de uma água dura, devido ao excesso de íons cálcio e magnésio.
Das afirmações acima, somente
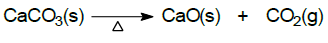
No processo químico apresentado ocorre
