Questões de Vestibular
Foram encontradas 391 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
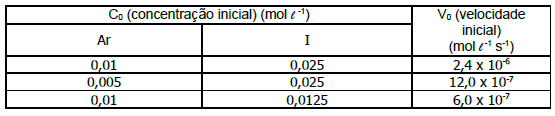
As substâncias nitrogenadas desempenham importante papel em nossa sociedade. Dentre as de maior importância estão a amônia e o ácido nítrico, usadas na fabricação do náilon e do poliuretano. A conversão de NH3 em NO com o uso de catalisador é o primeiro passo para a fabricação industrial do ácido nítrico e a rota industrial para a obtenção de substâncias oxigenadas do nitrogênio. A reação de produção de NO a partir de NH3 é:
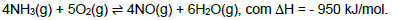
Quando a reação atinge o equilíbrio, uma maneira de aumentar a produção de NO(g) é aumentando a(o)
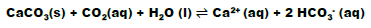
Analise as afirmativas sobre o sistema no equilíbrio e marque a alternativa CORRETA.
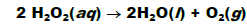
Na presença do íon brometo (Br- ), a decomposição ocorre rapidamente segundo as reações:
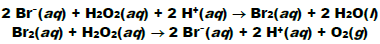
As reações vistas podem ser demonstradas graficamente a partir de um diagrama de energia potencial:
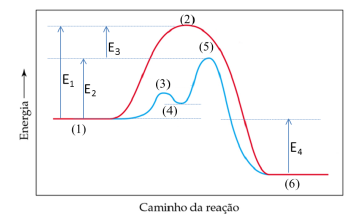
Em relação à decomposição do H2O2:
I. A reação sem catalisador acontece em apenas uma etapa e a reação com catalisador acontece em duas etapas, porém o produto formado é exatamente o mesmo.
II. E1 é a energia de ativação referente à decomposição do H2O2 na ausência de catalisador e E3 é a energia de ativação referente à decomposição do H2O2 na presença de catalisador. III. E2 é a energia de ativação da etapa determinante da velocidade da reação catalisada pelo íon Br- .
IV. E4 é a variação de entalpia da reação, que é endotérmica.
V. No gráfico, os pontos identificados por (2), (3) e (5) correspondem à energia dos complexos ativados para as reações representadas.
Assinale a alternativa CORRETA.
I. o aumento da concentração dos reagentes diminui a velocidade da reação.
II. quanto maior a área de contato entre as fases dos reagentes, maior será a velocidade da reação.
III. quanto maior a energia de ativação, mais lenta será a reação.
IV. o aumento da temperatura do sistema diminui a velocidade da reação.
V. o uso de catalisador diminui a energia de ativação e, portanto, aumenta a velocidade de uma reação.
Assinale a alternativa CORRETA.