Questões de Vestibular
Foram encontradas 437 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Os CFCs, utilizados como propelentes em sprays, ao atingirem a estratosfera, se decompõem sobre ação da radiação ultravioleta. Durante esse processo, átomos livres de cloro são formados e, ao reagirem com ozônio, O3(g), de acordo com a equação química, resumida, provocam a redução da concentração desse gás, diminuindo, assim, a proteção do planeta contra radiações ultravioleta.
Considerando-se essas informações, é correto afirmar:
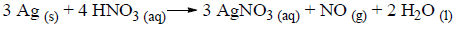
Calcule o volume de NO obtido a 27o C e 1 atm, a partir do consumo de 54 mg de prata. Dado: Ag = 108 g/mol.
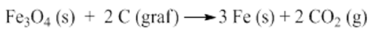
Sabendo que este processo tem um rendimento global de 85%, calcule a massa aproximada de magnetita que precisa ser reduzida para que se obtenha 42 toneladas de ferro. Considere as seguintes massas molares: C = 12 g/mol; O = 16 g/mol; Fe = 56 g/mol.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

O paracetamol (C8H9NO2) é o princípio ativo do medicamento Tylenol®, utilizado como analgésico e antitérmico. Pode ser comercializado na forma de solução oral (200 mg.mL–1) ou comprimido (500 mg ou 750 mg). É um dos analgésicos mais utilizados, porém é altamente perigoso para o fígado, devido ao seu alto potencial hepatotóxico, não devendo ser utilizados mais do que 8 comprimidos de 500 mg ao dia. Com base nessas informações, assinale o que for correto.