Questões de Vestibular
Foram encontradas 584 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
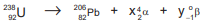
Um átomo pode emitir uma radiação alfa, 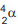 ou beta,
ou beta, 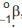 , e se
transformar em outro átomo, que, por sua vez, se desintegra
e se transforma em um terceiro e, assim, sucessivamente, até
a sequência chegar a um átomo estável. A sequência de
átomos é denominada série radioativa natural quando ocorre
de forma espontânea, na natureza com elementos radioativos.
A série do urânio 238, após decaimentes radioativos chega ao
chumbo 206,
, e se
transformar em outro átomo, que, por sua vez, se desintegra
e se transforma em um terceiro e, assim, sucessivamente, até
a sequência chegar a um átomo estável. A sequência de
átomos é denominada série radioativa natural quando ocorre
de forma espontânea, na natureza com elementos radioativos.
A série do urânio 238, após decaimentes radioativos chega ao
chumbo 206, 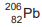 , átomo estável, como mostra a equação
nuclear global.
, átomo estável, como mostra a equação
nuclear global.
Considerando-se essas informações sobre a série radioativa
do urânio 238, é correto afirmar:
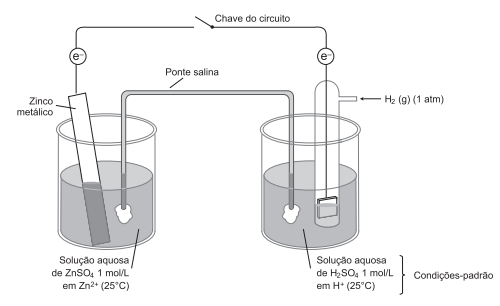
Os estudos sobre os fenômenos da oxirredução tornaram habitual a produção de energia a partir das reações eletroquímicas provenientes de pilhas e de baterias. A grande vantagem desses dispositivos é que são transportadores de energia elétrica e podem ser levados facilmente para qualquer lugar. A figura representa duas meias-células da pilha de zinco e hidrogênio, tendo o hidrogênio potencial-padrão de redução igual a zero.
Considerando-se as informações do texto e da ilustração, é correto afirmar:
I. C(s) + O2(g) → CO(g) ∆H° = − 110,0kJ
II. C(s) + O2(g) → CO2(g) ∆H° = − 394,0kJ
III. CO(g) + O2(g) → CO2(g)
Os conversores catalíticos dos veículos automotores são dispositivos usados para reduzir as emissões nocivas de poluentes atmosféricos. Nas grandes cidades, a dispersão de gases tóxicos torna-se potencialmente grave para a população, principalmente idosa e infantil. Atualmente, o uso de sistemas de injeção eletrônica e de catalisadores, nos escapamentos diminuem o lançamento de poluentes para a atmosfera. Os catalisadores aceleram reações químicas que transformam poluentes, como o monóxido de carbono, CO(g), em dióxido de carbono, CO2(g), menos prejudiciais à saúde.
Considerando-se essas informações e com base nos
conhecimentos de química, é correto concluir:
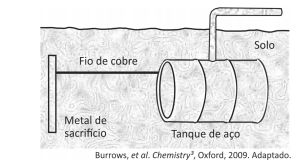
Um experimento para identificar quais metais podem ser utilizados como metal de sacrifício consiste na adição de um pedaço de metal a diferentes soluções contendo sais de outros metais, conforme ilustrado, e cujos resultados são mostrados na tabela. O símbolo ( + ) indica que foi observada uma reação química e o ( - ) indica que não se observou qualquer reação química.
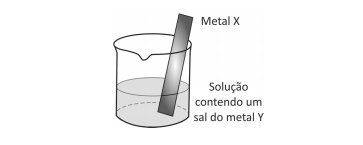
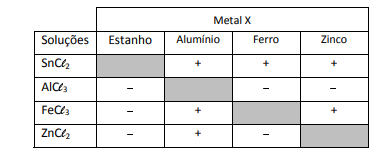 Da análise desses resultados, conclui-se que pode(m) ser
utilizado(s) como metal(is) de sacrifício para tanques de aço:
Da análise desses resultados, conclui-se que pode(m) ser
utilizado(s) como metal(is) de sacrifício para tanques de aço: Note e adote: o aço é uma liga metálica majoritariamente formada pelo elemento ferro.
6 CO2 (g) + 6 H2O (g) → C6H12O6 (aq) + 6 O2 (g) C6H12O6 (aq) → 2 C2H5OH (l) + 2 CO2 (g) ∆H = -70 kJ/mol C2H5OH (l)+ 3 O2 (g) → 2 CO2 (g) + 3 H2O (g) ∆H = -1.235 kJ/mol
Com base nessas informações, podemos afirmar que o valor de ∆H para a reação de fotossíntese é