Questões de Vestibular Comentadas por alunos sobre representação das transformações químicas em química
Foram encontradas 433 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
O ânion perxenato (XeO64-) é um oxidante muito forte, capaz de oxidar Mn(II) a Mn(VII), conforme a equação química abaixo:
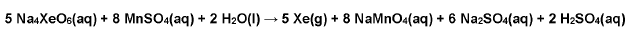
Além disso, o XeO64- é um oxidante limpo, pois não introduz produtos de redução no meio da reação, uma vez que o
xenônio formado está na forma de gás.
Um experimento foi realizado na temperatura de 300 K e 100 kPa, em que 16 mol de MnSO4 foram totalmente oxidados
por Na4XeO6 e todo o gás produzido foi coletado. Nessas condições, o volume de um mol de um gás ideal é
igual a 24,9 L.
O volume (em L) de gás coletado nesse experimento foi igual a:
HB + 4 O2 → HB(O2) 4
Em um experimento, constatou-se que 1 g de hemoglobina é capaz de transportar 2,24 x 10–4 L de oxigênio molecular com comportamento ideal, nas CNTP.
A massa molar, em g/mol, da hemoglobina utilizada no experimento é igual a:
No interior do casco dos navios, existem tanques que podem ter seu volume preenchido parcial ou totalmente com água do mar em função das necessidades de flutuabilidade.
Como os tanques são constituídos de materiais metálicos, eles sofrem, ao longo do tempo, corrosão pelo contato com a água do mar, conforme a equação:
4 Fe (s) + 3 O2 (g) 2 Fe2 O3 (s)
Um processo corrosivo no interior de um tanque fechado apresenta as seguintes características:

Admita que, durante todo o processo de corrosão, o ar no interior do tanque esteve submetido às CNTP, com comportamento ideal, e que apenas o oxigênio presente no ar foi consumido.
A massa de ferro, em quilogramas, consumida após o processo corrosivo foi igual a:
A equação química a seguir representa a obtenção de glicose a partir do glicogênio.
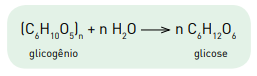
Considere uma molécula de glicogênio de massa molar igual a 4,86 x 106 g.mol−1 .
A metabolização da glicose originada da hidrólise dessa molécula de glicogênio proporciona
o ganho de energia, em quilojoules, equivalente a:
Dissolução
Au (s) +3 HNO3 (aq) + 4 HCl (aq) → HAuCl4 (aq) + 3 H2 O (l) + 3 NO2 (g)
Recuperação
3 NaHSO3 (aq) + 2 HAuCl4 (aq) + 3 H2 O (l) → 3 NaHSO4 (aq) + 8 HCl (aq) + 2 Au (s)
Admita que foram consumidos 252 g de HNO3 para a completa dissolução das medalhas. Nesse caso, a massa, de NaHSO3 , em gramas, necessária para a recuperação de todo o ouro corresponde a: