Questões de Vestibular
Foram encontradas 1.446 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Neste ano, celebram-se 150 anos da organização da tabela periódica, realizada por Mendeleev e, de acordo com os seus conhecimentos a respeito da tabela periódica atual, pode-se afirmar que
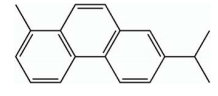 De acordo com a fórmula estrutural do reteno, representada acima, são feitas
as seguintes afirmações:
I. Trata-se de um hidrocarboneto com núcleos aromáticos condensados,
apresentando os grupos substituintes metil e isopropil.
II. Possui fórmula molecular C18H18 com 6 carbonos terciários sp2.
III. Apresenta isômeros geométricos cis/trans.
IV. É um composto de alta polaridade, por isso, foi detectado na água da chuva.
De acordo com a fórmula estrutural do reteno, representada acima, são feitas
as seguintes afirmações:
I. Trata-se de um hidrocarboneto com núcleos aromáticos condensados,
apresentando os grupos substituintes metil e isopropil.
II. Possui fórmula molecular C18H18 com 6 carbonos terciários sp2.
III. Apresenta isômeros geométricos cis/trans.
IV. É um composto de alta polaridade, por isso, foi detectado na água da chuva.
Estão corretas somente as afirmações

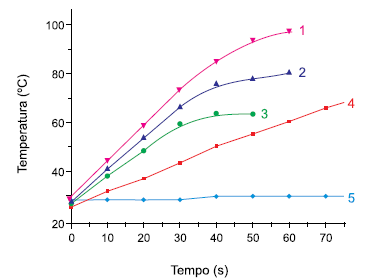
(Química Nova, vol. 24, no 6, 2001. Adaptado.)
A curva que ilustra o comportamento do n-hexano diante da radiação micro-ondas é representada pelo número