Questões de Vestibular Comentadas por alunos sobre transformações químicas em química
Foram encontradas 613 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Leia o texto abaixo.

Pivetta Marcos. Traquinagens etílicas. Revista Pesquisa FAPESP Dez 2003. [Adaptado]
O teste descrito no texto se baseia na propriedade dos átomos de carbono conhecida como
Leia a notícia abaixo divulgada em jornal maranhense.
“Furto de fiação elétrica, telefônica, de internet e de TV causa prejuízos em São Luís”. São cabos de cobre e de alumínio, levados por bandidos que furtam não apenas as redes de telefonia, mas principalmente a rede elétrica. Esses materiais são visados por criminosos por causa do alto valor de venda no mercado.
Jornal o Estado do Maranhão. Adaptado.
Pode-se afirmar em relação às propriedades dos metais
citados que
2NaN3 (s) → 2Na (s) + 3N2 (g)
Fonte: https://www.scientificamerican.com/article/how-do-air-bags-work/
Considere a pressão atmosférica de 1 atm, a temperatura de 300 K e R (constante universal dos gases ideais) = 0,08 atm L mol-1 K -1 .
O volume de gás nitrogênio, em m³ , liberado pela decomposição de 65 g de azida de sódio, é:
Nenhum lugar da casa se parece tanto com um laboratório de química quanto a cozinha, onde diversos ingredientes são misturados, queimados, fermentados e submetidos a processos dignos de experiências científicas. Assim como no laboratório, ter noções de química é essencial para que o cozinheiro consiga preparar corretamente os pratos, até os mais simples. Veja, por exemplo, como levar à perfeição a arte de cozinhar ovos.
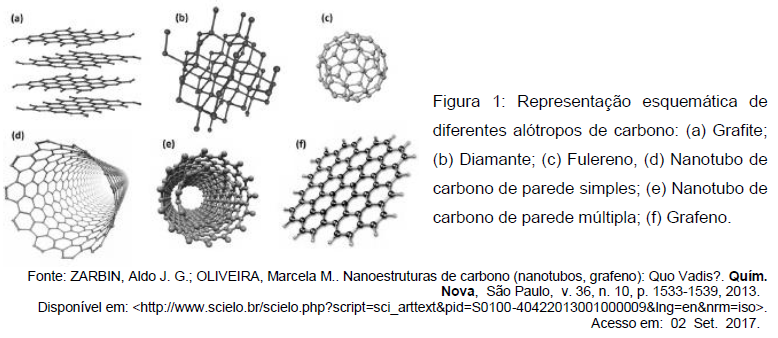
Com relação a este assunto, são feitas as seguintes afirmações.
I - O átomo de Carbono-12 possui em seu núcleo seis nêutrons e seis prótons.
II - A descoberta do C60 (Fig. 1c), que tem a forma de uma bola de futebol, impulsionou a descoberta de outras estruturas de fulerenos, principalmente materiais nanoestruturados, como os nanotubos de carbono. Estas substâncias simples possuem uma massa molar de 720 g/mol.
III - O átomo de carbono tem seis elétrons na sua eletrosfera, por isso, é chamado de hexavalente. Sendo assim, precisa apenas mais dois elétrons na sua camada de valência (camada mais externa) para obedecer à regra do octeto.
IV - Numa combustão completa, as moléculas orgânicas presentes nos combustíveis fósseis se ligam completamente ao gás oxigênio formando gás carbônico, que é um dos grandes responsáveis pelo efeito estufa.
V - Quanto à disposição dos átomos de carbono na cadeia carbônica das moléculas orgânicas, podemos classificá-las em Cadeia Normal (Reta ou Linear) ou Cadeia Ramificada.
Assinale a alternativa correta.