Questões de Vestibular
Foram encontradas 464 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Observe a reação abaixo, que representa a adição de uma solução de permanganato de potássio em uma solução de ácido clorídrico.
KMnO4(aq) + HCI(aq) -> KCI(aq) + MnCl2(aq) + Cl2(g) + H2O(I)
O coeficiente estequiométrico do ácido clorídrico
da reação balanceada é
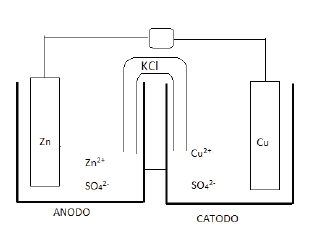
Analise as afirmações a seguir em relação ao funcionamento dessa pilha:
I. No anodo ocorre a oxidação do zinco e no catodo a redução do cobre. II. A carga do anodo é positiva e a do catodo negativa. III. O fluxo de elétrons ocorre do anodo para o catodo através do circuito externo. IV. Na placa de zinco, ocorre corrosão, liberando íons Zn2+ para a solução, enquanto que, na placa de cobre, ocorre deposição de Cu metálico. V. A função da ponte salina é balancear as cargas, sendo que os cátions K+ migram para a solução de sulfato de zinco e os ânions Cl- migram para a solução de sulfato de cobre. VI. O potencial padrão dessa pilha é 1,10 volts. VII. O Zn2+ é o agente oxidante e o Cu2+ é o agente redutor.
A alternativa que indica todas as afirmações CORRETAS é:

O princípio de funcionamento dessa espécie de ar-condicionado baseia-se no fato de o gelo sofrer uma
