Questões de Vestibular
Foram encontradas 584 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Pode-se concluir corretamente que, na combustão completa de 1 mol desse hidrocarboneto, as quantidades de matéria, e CO2 e de H2O produzidas são, em mol, respectivamente, iguais a
Leia o texto para responder a questão.
De onde vem o cheiro de carro novo?
De acordo com o gerente de uma montadora de veículos, o cheiro é composto por uma combinação de vários tipos de substâncias químicas usadas na fabricação do veículo, incluindo solventes, plásticos, colas, tecidos e borracha. Porém, muitas delas são altamente tóxicas, porque contêm Compostos Orgânicos Voláteis (COVs) em sua composição, como benzeno, tolueno e formol, que podem ser letais dependendo da quantidade. Eles acabam escapando e impregnando o ar, porque não requerem altas temperaturas para evaporarem.
<http://tinyurl.com/y8ucob6c> Acesso em: 13.11.2017. Adaptado.
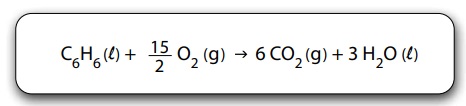
A entalpia de combustão do benzeno pode ser determinada conhecendo-se os valores das entalpias de formação do gás carbônico, assim como da água e do benzeno líquidos.
A tabela apresenta os valores de entalpia de formação de algumas substâncias nas condições padrão.
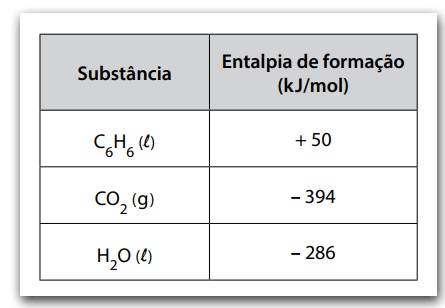
A entalpia de combustão completa do benzeno, em kJ/mol, é
A nitroglicerina - C3H5(NO3)3 – é um nitrato de alquila, descoberta em 1847 por Ascanio Sobrero (químico italiano, 1812-1888), que a obteve misturando glicerina, ácido nítrico e ácido sulfúrico. No estado puro e à temperatura ambiente, a nitroglicerina é um líquido muito explosivo e perigoso. Em 1867, Alfred Nobel (químico sueco, 1833-1896) realizou testes no sentido de melhorar a manipulação da nitroglicerina, misturando-a com materiais inertes, como sílica, pós cerâmicos, argila, gesso, carvão e terras diatomáceas. Esses materiais, agora moldáveis, viriam a se tornar um explosivo muito importante, conhecido como dinamite.
A equação abaixo (não balanceada) representa a reação de decomposição da nitroglicerina:
C3H5(NO3)3(l) → N2(g) + O2(g) + CO2(g) + H2O(g) (não balanceada)
Dados: ∆Hf C3H5(NO3)3(l) = -364 kJ/mol; ∆Hf CO2(g) = -393 kJ/mol; ∆Hf H2O(g)= -242 kJ/mol
De posse das informações, assinale a alternativa que representa a variação de entalpia da reação acima, em kJ por mol de nitroglicerina.
Em 1915, o exército alemão utilizou, pela primeira vez, bombas de gás cloro contra trincheiras francesas e argelinas, causando a morte em mais de 5 mil soldados. O cloro gasoso pode ser utilizado na fabricação de solventes clorados, inseticidas (DDT), purificação de água, produção de compostos inorgânicos como hipoclorito de sódio (NaOCl), cloretos metálicos. Uma forma de produzir cloro gasoso em pequenas quantidades é pela reação entre permanganato de potássio e ácido clorídrico, apresentada a seguir:
KMnO4 (s) + HCl (aq) → KCl (aq) + MnCl2 (aq) + Cl2 (g) + H2O (l)
Sobre essa reação, analise as proposições.
I. Trata-se de uma reação de oxirredução, em que o cloreto sofre oxidação e o manganês sofre redução.
II. A reação está balanceada.
III. A reação não está balanceada, sendo os coeficientes estequiométricos para essa reação 2:16:2:2:5:8.
IV. O estado de oxidação do átomo de manganês passa de 7+ para 2+, nessa reação, tratando-se de uma redução.
V. O cloreto é o agente redutor nesta reação.
Assinale a alternativa correta.