Questões de Vestibular
Foram encontradas 451 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
O ácido nítrico é um importante insumo para produção de fertilizantes, explosivos e tintas. Sua produção industrial é feita pelo processo Ostwald, em três etapas que podem ser representadas pelas reações:
I. 6 NH3 (g) + 15/2 O2 (g) → 6 NO (g) + 9 H2O (g) ∆H = – 1378 kJ
II. 6 NO (g) + 3 O2 (g) → 6 NO2 (g) ∆H = – 339 kJ
III. 6 NO2
(g) + 2 H2O (g) → 4 HNO3
(aq) + 2 NO (g) ∆H = – 270 kJ
A medicina tem desenvolvido diversos tratamentos para pacientes com câncer de cérebro. Em um deles, o paciente ingere o composto borofenilalanina. Essa molécula que contém o isótopo boro-10 tem afinidade pelas células cerebrais. Após a ingestão, o paciente é submetido a um feixe de nêutrons. Cada isótopo de boro-10 captura um nêutron e forma um isótopo instável que se fissiona em duas espécies menores e emite ainda radiação gama. Dessa maneira, a célula tumoral é atingida pela energia das emissões do processo de fissão e é destruída.
(www.nipe.unicamp.br/enumas/admin/resources/uploads/robertovicente_hasoluçao.pdf.Adaptado)
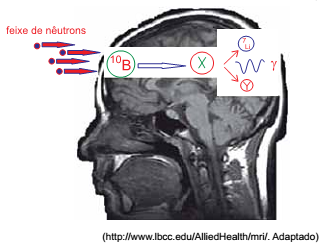
O isótopo instável, representado por X, e a espécie emitida
na fissão, representada por Y, são, respectivamente,
Pouco depois de a bomba atômica ser lançada sobre o Japão, cientistas inventaram outra arma, ainda mais poderosa: a bomba de hidrogênio. Em 1957, a bomba H explodia no atol de Bikini, no Oceano Pacífico.Tinha um poder de destruição cinco vezes maior do que todas as bombas convencionais detonadas durante a Segunda Guerra Mundial.
Prevendo a corrida armamentista, Albert Einstein declarou em 1945: “O poder incontrolado do átomo mudou tudo, exceto nossa forma de pensar e, por isso, caminhamos para uma catástrofe sem paralelo".

Disponível em:<http://www.sitedecuriosidades.com/curiosidade/as-bombas-atomicas-lancadas-sobre-o-japao.html><http://www.nippo.com.br/4.hiroshima/>.<http://pt.wikipedia.org/wiki/Bombardeamentos de Hiroshima e Nagasaki>. Acesso em: 2 set. 15.
Em relação à temática e às informações apresentadas no texto, assinale a alternativa correta.
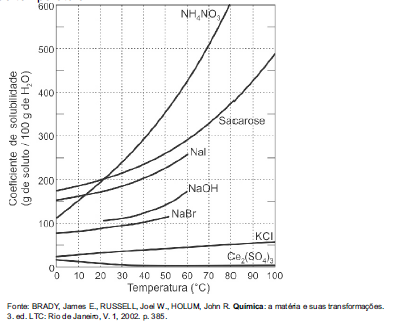
Considerando as informações apresentadas pelo gráfico acima, assinale a alternativa correta.
A equação química que descreve, simplificadamente, o processo de obtenção industrial do 1,2-dicloroetano, a partir da reação de adição de gás cloro ao eteno, encontra-se representada abaixo.
C2H4(g) + Cℓ2(g) ® C2H4Cℓ2(ℓ)
Disponível em:<http://laboratorios.cetesb.sp.gov.br/wp-content/uploads/sites/47/2013/11/dicloroetano.pdf>. Acesso em: 3 set. 15. (Adaptado.)
A variação de entalpia da reação acima é igual a
Dados:
Ligação Energia de ligação (kJ/mol)
C–H 413,4
C–Cℓ 327,2
C–C 346,8
C=C 614,2
Cℓ–Cℓ 242,6