Questões de Vestibular Sobre termoquímica: energia calorífica, calor de reação, entalpia, equações e lei de hess. em química
Foram encontradas 341 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
O isoctano líquido (C8H18) e o gás hidrogênio são importantes combustíveis. O primeiro está presente na gasolina; o segundo, na propulsão de foguetes.
As entalpias aproximadas de formação do gás carbônico, do vapor de água e do isoctano líquido (C8H18) são, respectivamente, –393, –242 e –259 kJ/mol.
A partir desses dados, o calor liberado na combustão de 1 kg de hidrogênio gasoso é, aproximadamente, ________ vezes maior do que o calor liberado na combustão de 1 kg de isoctano líquido.
O outro
Ele me olhou como se estivesse descobrindo o mundo. Me olhou e reolhou em fração de segundo. Só vi isso porque estava olhando-o na mesma sintonia. A singularização do olhar. Tentei disfarçar virando o pescoço para a direita e para a esquerda, como se estivesse fazendo um exercício, e numa dessas viradas olhei rapidamente para ele no volante. Ele me olhava e volveu rapidamente os olhos, fingindo estar tirando um cisco da camisa. Era um ser de meia idade, os cabelos com alguns fios grisalhos, postura de gente séria, camisa branca, um cidadão comum que jamais flertaria com outra pessoa no trânsito. E assim, enquanto o semáforo estava no vermelho para nós, ficou esse jogo de olhares que não queriam se fixar, mas observar o outro espécime que nada tinha de diferente e ao mesmo tempo tinha tudo de diferente. Ele era o outro e isso era tudo. É como se, na igualdade de milhares de humanos, de repente, o ser se redescobrisse num outro espécime. Quando o semáforo ficou verde, nós nos olhamos e acionamos os motores.
(GONÇALVES, Aguinaldo. Das estampas. São Paulo: Nankin, 2013. p. 130.)
“Quando o semáforo ficou verde, nós nos olhamos e acionamos os motores."
Os motores de combustão interna conseguem transformar a energia química em energia mecânica. Na maioria dos automóveis, temos motores de ignição por centelha de quatro tempos. O ciclo de funcionamento de um motor de quatro tempos apresenta quatro etapas: admissão, compressão, combustão/expansão e exaustão. A respeito do texto acima, analise as afirmativas a seguir:
I-A energia liberada de uma reação de combustão é dada pelo balanço da energia necessária para romper as ligações do combustível e da energia necessária para formar as ligações dos produtos da reação, sendo que a primeira é sempre maior que a última.
II- Pode-se dizer que o aumento da temperatura na combustão leva ao aumento do grau de desordem do sistema.
III-Considerando-se apenas a câmara de combustão do motor, pode-se afirmar que os gases resultantes da combustão vão aumentar a pressão no interior desta.
IV-Os produtos de uma reação de combustão completa são sempre CO e H2O.
Em relação às proposições analisadas, assinale a única alternativa cujos itens estão todos corretos:
Em um caderno foram encontradas algumas afirmações a respeito desse diagrama.
I. O calor de formação da água líquida no estado padrão é de 971 kJ/mol.
II. A combustão de um mol de gás hidrogênio gerando água no estado líquido libera 286 kJ.
III. A energia de ligação O=O é de 498 kJ/mol. IV. A vaporização de um mol de água libera 44 kJ.
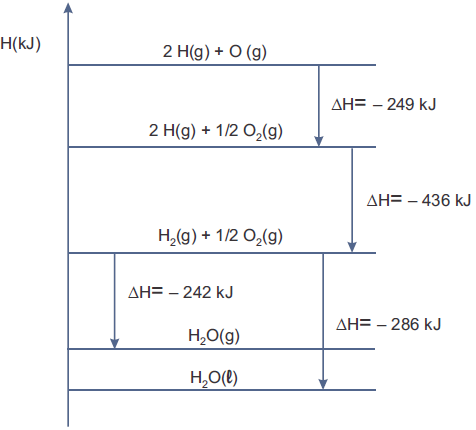
Estão corretas apenas as afirmações