Questões do Enem
Sobre eletroquímica: oxirredução, potenciais padrão de redução, pilha, eletrólise e leis de faraday. em química
Foram encontradas 35 questões

NAM, D.-H.; CHOI, K.-S. Bismuth as a New Chloride-Storage Electrode Enabling the Construction of a Practical High Capacity Desalination Battery. Journal of the American Chemical Society, n. 139, 2017 (adaptado).
Durante a dessalinização da água por eletrólise ocorre a formação de

CH3COO− (aq) + 2 H2O (I) → 2 CO2 (g) + 7 H+ (aq) + 8 e−
4 H+ (aq) + O2 (g) + 4 e− → 2 H2O (I)
QUINTO, A. C. Biobaterias geram eletricidade a partir de esgoto sanitário e efluentes agroindustriais. Disponível em: https://jornal.usp.br. Acesso em: 1 dez. 2021 (adaptado).
Qual das equações representa a reação global que ocorre durante o funcionamento dessa CCM?
A figura ilustra de solos esquematicamente um processo de remediação de solos contaminados com tricloroeteno (TCE), um agente desengraxante. Em razão de vazamentos de tanques de estocagem ou de manejo inapropriado de resíduos industriais, ele se encontra presente em águas subterrâneas, nas quais forma uma fase líquida densa não aquosa (DNAPL) que se deposita no fundo do aquífero. Essa tecnologia de descontaminação emprega o Íon persulfato (S2O82-), que é convertido no radical •SO4- por minerais que contêm Fe(Ill). O esquema representa de forma simplificada o mecanismo de ação química sobre o TCE e a formação dos produtos de degradação.
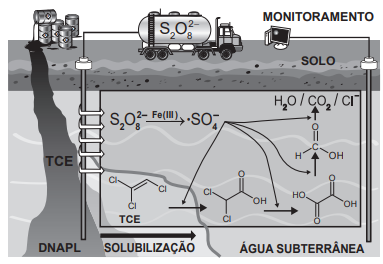
Esse procedimento de remediação de águas subterrâneas baseia-se em reações de
A nanotecnologia é responsável pelo aprimoramento de diversos materiais, incluindo os que são impactados com a presença de poluentes e da umidade na atmosfera, causadores de corrosão. O processo de corrosão é espontâneo e provoca a deterioração de metais como o ferro, que, em presença de oxigênio e água, sofre oxidação, conforme ilustra a equação química:
4Fe(s) + 2H2O(I) + 3O2(g) → 2 Fe2O3 ˑ H2O (s)
Uma forma de garantir a durabilidade da estrutura metálica e a sua resistência à umidade consiste na deposição de filmes finos nanocerâmicos à base de zircônia (ZrO2) e alumina (AL2O3) sobre a superficie do objeto que se deseja proteger.
CLEMENTE. G. A. B. F. et al. O uso de matenais hibridos ou nanocompósitos como revestimentos anticorrosivos do aço. Quimica Nova, n. 9, 2021 (adaplado).
Essa nanotecnologia aplicada na proteção contra a
corrosão se baseia no(a)

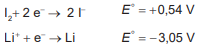
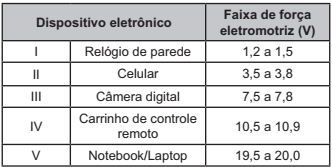
Essa bateria é adequada para o funcionamento de qual dispositivo eletrônico?
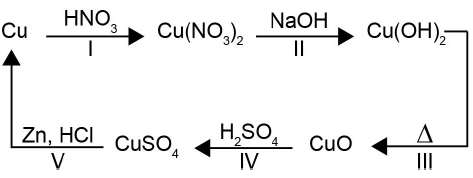
A reação de redução do cobre ocorre na etapa

Considere que uma bateria é construída pela associação em série de três pilhas de lítio-iodo, nas condições-padrão, conforme as semiequações de redução apresentadas.
I2 + 2 e- → 2 I- E° = + 0,54V
Li+ + e- → Li E° = - 3,05 V

Essa bateria é adequada para o funcionamento de qual dispositivo eletrônico?
Suponha que seja necessário usar um metal de sacrifício em um tanque de aço (liga de ferro-carbono). Considere as semirreações de redução e seus respectivos potenciais padrão.
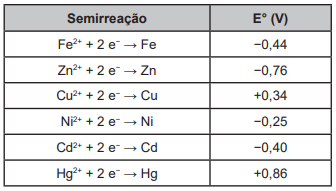
Dos metais citados, o que garantirá proteção ao tanque de aço é o
A explicação correta de a maresia acelerar a corrosão do aço é porque
Os objetos de prata tendem a escurecer com o tempo, em contato com compostos de enxofre, por causa da formação de uma película superficial de sulfeto de prata (Ag2S), que é escuro. Um método muito simples para restaurar a superfície original desses objetos é mergulhá-los em uma solução diluída aquecida de hidróxido de sódio (NaOH), contida em uma panela comum de alumínio. A equação química que ilustra esse processo é:
3 Ag2S (s) + 2 Al (s) + 8 NaOH (aq) → 6 Ag (s) + 3 Na2S (aq) + 2 NaAlO2 (aq) + 4 H2O (l)
A restauração do objeto de prata ocorre por causa do(a)
As pilhas recarregáveis, bastante utilizadas atualmente, são formadas por sistemas queatuam como uma célula galvânica, enquanto estão sendo descarregadas, e como célulaeletrolítica, quando estão sendo recarregadas.
Uma pilha é formada pelos elementos níquel e cádmio e seu carregador deve forneceruma diferença de potencial mínima para promover a recarga. Quanto maior a diferença depotencial gerada pelo carregador, maior será o seu custo. Considere os valores de potencialpadrão de redução dessas espécies:
Ni2+ (aq) + 2 e− ⇌ Ni (s) E° = −0,230 V
Cd2+ (aq) + 2 e− ⇌ Cd (s) E° = −0,402 V
Teoricamente, para que um carregador seja ao mesmo tempo eficiente e tenha o menor preço,
a diferença de potencial mínima, em volt, que ele deve superar é de
A propriedade que o metal associado ao cobre deve apresentar para impedir a formação de zinabre nas moedas é, em relação ao cobre,
Estudos mostram o desenvolvimento de biochips utilizados para auxiliar o diagnóstico de diabetes melito, doença evidenciada pelo excesso de glicose no organismo. O teste é simples e consiste em duas reações sequenciais na superfície do biochip, entre a amostra de soro sanguíneo do paciente, enzimas específicas e reagente (iodeto de potássio, KI), conforme mostrado na imagem.
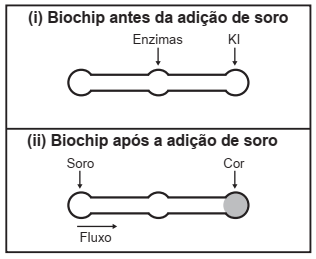
Após a adição de soro sanguíneo, o fluxo desloca- -se espontaneamente da esquerda para a direita (ii) promovendo reações sequenciais, conforme as equações 1 e 2. Na primeira, há conversão de glicose do sangue em ácido glucônico, gerando peróxido de hidrogênio:
Equação 1
C6H12O6 (aq) + O2 (g) + H2O (l)  C6H12O7 (aq) + H2O2 (aq)
C6H12O7 (aq) + H2O2 (aq)
Na segunda, o peróxido de hidrogênio reage com íons iodeto gerando o íon tri-iodeto, água e oxigênio.
Equação 2
2 H2O2 (aq) + 3 l− (aq) → I3− (aq) + 2 H2O (I) + O2 (g)
GARCIA, P. T. et al. A Handheld Stamping Process to Fabricate Microfluidic Paper-Based Analytical Devices with Chemically Modified Surface for Clinical Assays. RSC Advances, v. 4, 13 ago. 2014 (adaptado).
O tipo de reação que ocorre na superfície do biochip,
nas duas reações do processo, é
Grupos de pesquisa em todo o mundo vêm buscando soluções inovadoras, visando a produção de dispositivos para a geração de energia elétrica. Dentre eles, pode-se destacar as baterias de zinco-ar, que combinam o oxigênio atmosférico e o metal zinco em um eletrólito aquoso de caráter alcalino. O esquema de funcionamento da bateria zinco-ar está apresentado na figura.
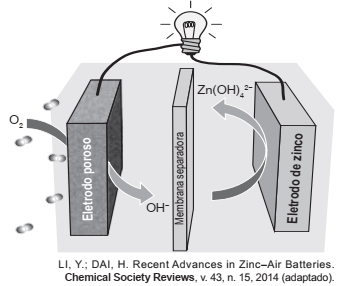
No funcionamento da bateria, a espécie química formada
no ânodo é
Para realizar o desentupimento de tubulações de esgotos residenciais, é utilizada uma mistura sólida comercial que contém hidróxido de sódio (NaOH) e outra espécie química pulverizada. Quando é adicionada água a essa mistura, ocorre uma reação que libera gás hidrogênio e energia na forma de calor, aumentando a eficiência do processo de desentupimento. Considere os potenciais padrão de redução (Eo) da água e de outras espécies em meio básico, expressos no quadro.
Semirreação de redução Eo (V)
2 H2O + 2 e− → H2 + 2 OH− −0,83
Co(OH)2 + 2 e− → Co + 2 OH− −0,73
Cu(OH)2 + 2 e− → Cu + 2 OH− −0,22
PbO + H2O + 2 e− → Pb + 2 OH− −0,58
Al(OH)4− + 3 e− → Al + 4 OH− −2,33
Fe(OH)2 + 2 e− → Fe + 2 OH− −0,88
Qual é a outra espécie que está presente na composição
da mistura sólida comercial para aumentar sua eficiência?
Células solares à base de TiO2 sensibilizadas por corantes (S) são promissoras e poderão vir a substituir as células de silício. Nessas células, o corante adsorvido sobre o TiO2 é responsável por absorver a energia luminosa (hv), e o corante excitado (S*) é capaz de transferir elétrons para o TiO2. Um esquema dessa célula e os processos envolvidos estão ilustrados na figura. A conversão de energia solar em elétrica ocorre por meio da sequência de reações apresentadas.
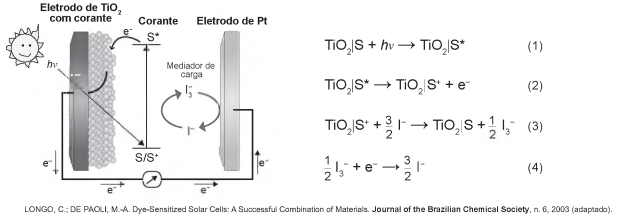
A reação 3 é fundamental para o contínuo funcionamento da célula solar, pois
Em 1938 o arqueólogo alemão Wilhelm Konig, diretor
do Museu Nacional do Iraque, encontrou um objeto
estranho na coleção da instituição, que poderia ter sido
usado como uma pilha, similar às utilizadas em nossos
dias. A suposta pilha, datada de cerca de 200 a.C., é
constituída de um pequeno vaso de barro (argila) no qual
foram instalados um tubo de cobre, uma barra de ferro
(aparentemente corroída por ácido) e uma tampa de
betume (asfalto), conforme ilustrado. Considere os
potenciais-padrão de redução:  (Fe2+|Fe) = -0,44 V;
(Fe2+|Fe) = -0,44 V;
 (H+|H2) = 0,00 V; e
(H+|H2) = 0,00 V; e  (Cu2+|Cu) = +0,34 V.
(Cu2+|Cu) = +0,34 V.
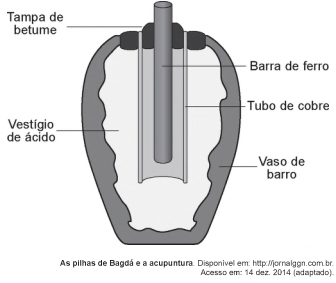
Nessa suposta pilha, qual dos componentes atuaria como
cátodo?
O ferro metálico é obtido em altos-fornos pela mistura do minério hematita (α-Fe2O3) contendo impurezas, coque (C) e calcário (CaCO3), sendo estes mantidos sob um fluxo de ar quente que leva à queima do coque, com a temperatura no alto-forno chegando próximo a 2 000 °C. As etapas caracterizam o processo em função da temperatura.
Entre 200 °C e 700 °C:
3 Fe2O3 + CO → 2 Fe3O4 + CO2
CaCO3 → CaO + CO2
Fe3O4 + CO → 3 FeO + CO2
Entre 700 °C e 1 200 °C:
C + CO2 → 2 CO
FeO + CO → Fe + CO2
Entre 1 200 °C e 2 000 °C:
Ferro impuro se funde
Formação de escória fundida (CaSiO3)
2 C + O2 → 2 CO
BROWN, T L.; LEMAY, H. E.; BURSTEN, B. E. Química: a ciência central. São Paulo: Pearson Education, 2005 (adaptado).
No processo de redução desse metal, o agente redutor é o
A invenção do LED azul, que permite a geração de outras cores para compor a luz branca, permitiu a construção de lâmpadas energeticamente mais eficientes e mais duráveis do que as incandescentes e fluorescentes. Em um experimento de laboratório, pretende-se associar duas pilhas em série para acender um LED azul que requer 3,6 volts para o seu funcionamento. Considere as semirreações de redução e seus respectivos potenciais mostrados no quadro.

Qual associação em série de pilhas fornece diferença de potencial, nas condições-padrão, suficiente para acender o LED azul?
A eletrólise é um processo não espontâneo de grande importância para a indústria química. Uma de suas aplicações é a obtenção do gás cloro e do hidróxido de sódio, a partir de uma solução aquosa de cloreto de sódio. Nesse procedimento, utiliza-se uma célula eletroquímica, como ilustrado.
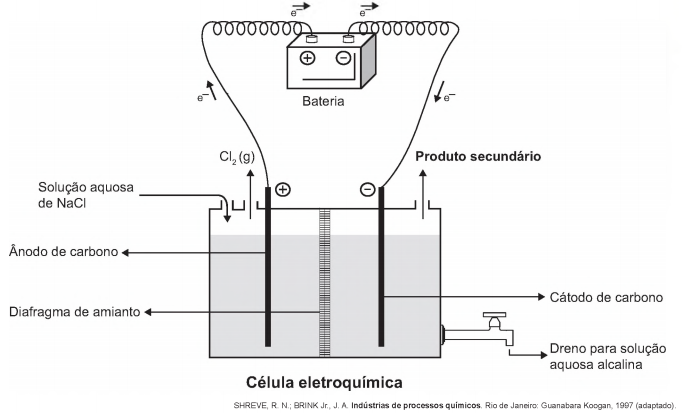
No processo eletrolítico ilustrado, o produto secundário obtido é o