Questões do Enem
Sobre estudo da matéria: substâncias, misturas, processos de separação. em química
Foram encontradas 34 questões
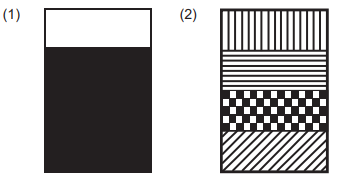
As propriedades de líquidos e soluções que justificam os resultados obtidos nos experimentos 1 e 2 são
bula de um determinado medicamento traz as seguintes informações:

De acordo com as informações apresentadas na bula,
a substância que se encontra em maior concentração
e a não condutora de corrente elétrica, quando em
solução aquosa, são, respectivamente,
24 Ag (s) + 8 Sn (s) + 37 Hg (l) → 12 Ag2 Hg3 (s) + Sn8 Hg (s)
Os materiais formados pelos elementos citados são caracterizados como
Hg2(NO3 )2 (aq) + 2 NaCl (aq) ➝ Hg2Cl2 (s) + 2 NaNO3 (aq)
Na dúvida sobre a massa de NaCl a ser utilizada, o assistente aumentou gradativamente a quantidade adicionada em cada frasco, como apresentado no quadro.
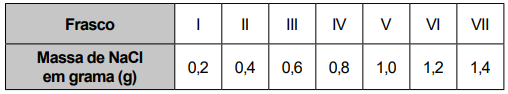
O produto obtido em cada experimento foi filtrado, secado e teve sua massa aferida. O assistente organizou os resultados na forma de um gráfico que correlaciona a massa de NaCl adicionada com a massa de Hg2Cl2 obtida em cada frasco. A massa molar do Hg2 (NO3 )2 é 525 g mol–1, a do NaCl é 58 g mol–1 e a do Hg2Cl2 é 472 g mol–1.
Qual foi o gráfico obtido pelo assistente de laboratório?
Atualização da recomendação da Sociedade Portuguesa de Neonatologia. Disponível em: www.spneonatologia.pt. Acesso em: 22 out. 2021 (adaptado).
Caso esse suplemento seja acondicionado em embalagem desse tipo de vidro, o risco de contaminação por alumínio será maior se o(a)
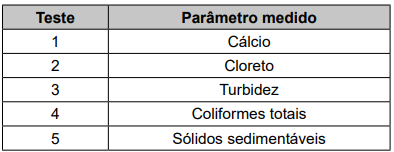
Qual teste deve ser considerado para controlar a formação desse tipo de obstrução de tubulações?
A água bruta coletada de mananciais apresenta alto índice de sólidos suspensos, o que a deixa com um aspecto turvo. Para se obter uma água límpida e potável, ela deve passar por um processo de purificação numa estação de tratamento de água. Nesse processo, as principais etapas são, nesta ordem: coagulação, decantação, filtração, desinfecção e fluoretação.
Qual é a etapa de retirada de grande parte desses sólidos?
A figura é uma representação esquemática de uma estação de tratamento de água. Nela podem ser observadas as etapas que vão desde a captação em represas até a distribuição à população. No intuito de minimizar o custo com o tratamento, foi proposta a eliminação da etapa de adição de hipoclorito de sódio e o resultado foi comparado com o da água tratada em todas as etapas.
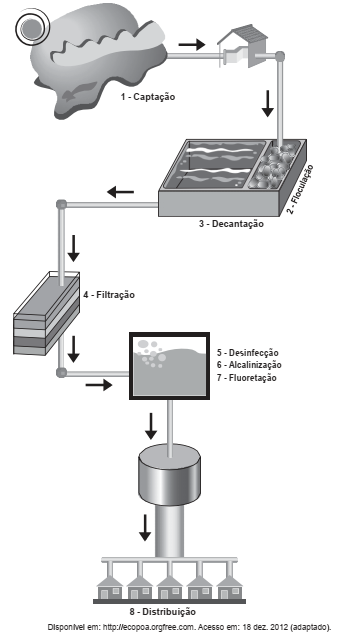
Caso fosse aceita a proposta apresentada, qual seria a
mudança principal observada na qualidade da água que
seria distribuída às residências?
Para preparar o vinho de laranja, caldo de açúcar é misturado com suco de laranja, e a mistura é passada em panos para retenção das impurezas. O líquido resultante é armazenado em garrafões, que são tampados com rolhas de cortiça. Após oito dias de repouso, as rolhas são substituídas por cilindros de bambu e, finalmente, após dois meses em repouso ocorre novamente a troca dos cilindros de bambu pelas rolhas de cortiça.
RESENDE, D. R.; CASTRO, R. A.; PINHEIRO, P. C. O saber popular nas aulas de química: relato de experiência envolvendo a produção do vinho de laranja e sua interpretação no ensino médio. Química Nova na Escola, n. 3, ago. 2010 (adaptado).
Os processos físico e químico que ocorrem na fabricação dessa bebida são, respectivamente,
Para demonstrar os processos físicos de separação de componentes em misturas complexas, um professor de química apresentou para seus alunos uma mistura de limalha de ferro, areia, cloreto de sódio, bolinhas de isopor e grãos de feijão. Os componentes foram separados em etapas, na seguinte ordem:
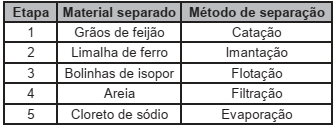
Em qual etapa foi necessário adicionar água para dar
sequência às separações?

Entre os materiais mais usados no nosso dia a dia destacam-se os plásticos, constituídos por polímeros. A consequência de seu amplo uso é a geração de resíduos, que necessitam de um destino final adequado em termos ambientais. Uma das alternativas tem sido a reciclagem, que deve respeitar as características dos polímeros que compõem o material. Esse processo envolve algumas etapas, como: separação do resíduo (catação), moagem, hidrólise, lavagem, secagem, pirólise e aquecimento (fusão).
SPINACÉ, M. A. S., PAOLI, M. A. D. Tecnologia de reciclagem de polímeros. Química Nova, n.1, 2005 (adaptado).
Quais das etapas citadas do processo de reciclagem são classificadas como métodos
químicos?
As populares pilhas zinco-carbono (alcalinas e de Leclanché) são compostas por um invólucro externo de aço (liga de ferro-carbono), um ânodo (zinco metálico), um cátodo (grafita) e um eletrólito (MnO2 mais NH4Cl ou KOH), contido em uma massa úmida com carbono chamada pasta eletrolítica. Os processos de reciclagem, geralmente propostos para essas pilhas usadas, têm como ponto de partida a moagem (trituração). Na sequência, uma das etapas é a separação do aço, presente no invólucro externo, dos demais componentes.
Que processo aplicado à pilha moída permite obter essa separação?
A obtenção de óleos vegetais, de maneira geral, passa pelas etapas descritas no quadro.
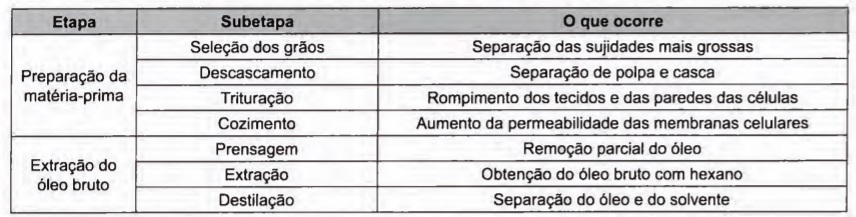
Qual das subetapas do processo é realizada em função apenas da polaridade das substâncias?
Considere os dados do acetato de etila: • Baixa solubilidade em água; • Massa específica = 0,9 g cm-3; • Temperatura de fusão = - 83 °C; • Pressão de vapor maior que a da água.
A fim de tratar o resíduo, recuperando o acetato de etila, o técnico deve
A primeira etapa desse beneficiamento é a
O processo descrito para a purificação da água é denominado
A identificação de riscos de produtos perigosos para o transporte rodoviário é obrigatória e realizada por meio da sinalização composta por um painel de segurança, de cor alaranjada, e um rótulo de risco. As informações inseridas no painel de segurança e no rótulo de risco, conforme determina a legislação, permitem que se identifique o produto transportado e os perigos a ele associados.
A sinalização mostrada identifica uma substância que está sendo transportada em um caminhão.

Os três algarismos da parte superior do painel indicam o “Número de risco”. O número 268 indica tratar-se de um gás (2), tóxico (6) e corrosivo (8). Os quatro dígitos da parte inferior correspondem ao “Número ONU”, que identifica o produto transportado.
BRASIL. Resolução n. 420, de 12/02/2004, da Agência Nacional de Transportes Terrestres (ANTT)/Ministério dos Transportes (adaptado).
ABNT. NBR 7500: identificação para o transporte terrestre, manuseio, movimentação e armazenamento de produtos. Rio de Janeiro, 2004 (adaptado).
Considerando a identificação apresentada no caminhão,
o código 1005 corresponde à substância
A cromatografia em papel é um método de separação que se baseia na migração diferencial dos componentes de uma mistura entre duas fases imiscíveis. Os componentes da amostra são separados entre a fase estacionária e a fase móvel em movimento no papel. A fase estacionária consiste de celulose praticamente pura, que pode absorver até 22 % de água. É a água absorvida que funciona como fase estacionária líquida e que interage com a fase móvel, também líquida (partição líquido-líquido). Os componentes capazes de formar interações intermoleculares mais fortes com a fase estacionária migram mais lentamente.
Uma mistura de hexano com 5% (v/v) de acetona foi utilizada como fase móvel na separação dos componentes de um extrato vegetal obtido a partir de pimentões. Considere que esse extrato contém as substâncias representadas.
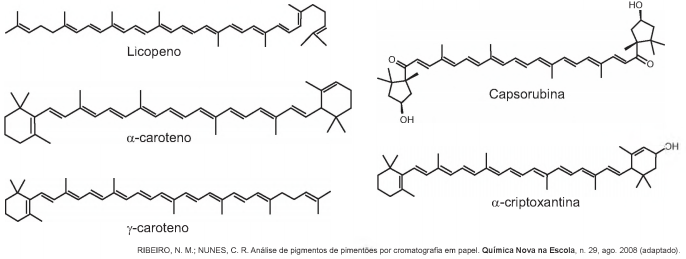
A substância presente na mistura que migra mais lentamente é o(a)
As centrífugas são equipamentos utilizados em laboratórios, clínicas e indústrias. Seu funcionamento faz uso da aceleração centrífuga obtida pela rotação de um recipiente e que serve para a separação de sólidos em suspensão em líquidos ou de líquidos misturados entre si.
RODITI, I. Dicionário Houaiss de física. Rio de Janeiro: Objetiva, 2005 (adaptado).
Nesse aparelho, a separação das substâncias ocorre em função