Questões do Enem
Comentadas sobre fórmulas, balanceamento e leis ponderais das reações químicas em química
Foram encontradas 22 questões
As plantas realizam fotossíntese pela captura do gás carbônico atmosférico e, juntamente com a água e a luz solar, produzem os carboidratos. No esquema está apresentada a equação desse processo, em que as letras x e y representam os coeficientes estequiométricos da reação.
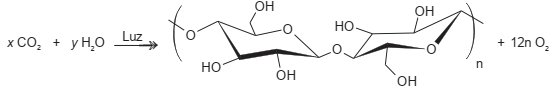
Quais são os valores dos coeficientes x e y da equação balanceada de produção do carboidrato e oxigênio?
Supondo a queima completa de 100 g de carvão antracito, a massa de gás liberada na atmosfera é, em grama, mais próxima de
A diferença de emissão de CO2 dos carros desse fabricante em relação ao limite estabelecido na União Europeia é
Objetos de prata sofrem escurecimento devido à sua reação com enxofre. Estes materiais recuperam seu brilho característico quando envoltos por papel alumínio e mergulhados em um recipiente contendo água quente e sal de cozinha.
A reação não balanceada que ocorre é:
Ag2S (s) + Al (s) → Al2S3 (s) + Ag (s)
Dados da massa molar dos elementos (g mol-1): Ag = 108; S = 32.
UCKO, D. A. Química para as ciências da saúde: uma introdução à química geral, orgânica e biológica. São Paulo: Manole, 1995 (adaptado).
Utilizando o processo descrito, a massa de prata metálica que será regenerada na superfície de um objeto que contém 2,48 g de Ag2S é
Pesquisadores desenvolveram uma nova e mais eficiente rota sintética para produzir a substância atorvastatina, empregada para reduzir os níveis de colesterol. Segundo os autores, com base nessa descoberta, a síntese da atorvastatina cálcica (CaC66H68F2N4O10, massa molar igual a 1 154 g/mol ) é realizada a partir do éster 4-metil-3-oxopentanoato de metila (C7H12O3, massa molar igual a 144 g/mol).
Unicamp descobre nova rota para produzir medicamento mais vendido no mundo. Disponível em: www.unicamp.br. Acesso em: 26 out. 2015 (adaptado).
Considere o rendimento global de 20% na síntese da atorvastatina cálcica a partir desse éster, na proporção de1:1. Simplificadamente, o processo é ilustrado na figura.
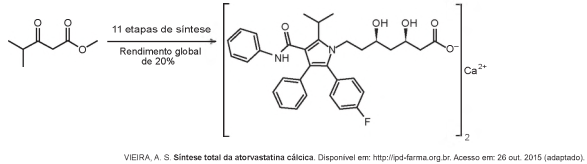
Considerando o processo descrito, a massa, em grama, de atorvastatina cálcica obtida a partir de 100 g do éster é
mais próxima de
As abelhas utilizam a sinalização química para distinguir a abelha-rainha de uma operária, sendo capazes de reconhecer diferenças entre moléculas. A rainha produz o sinalizador químico conhecido como ácido 9-hidroxidec-2-enoico, enquanto as abelhas-operárias produzem ácido 10-hidroxidec-2-enoico. Nós podemos distinguir as abelhas-operárias e rainhas por sua aparência, mas, entre si, elas usam essa sinalização química para perceber a diferença. Pode-se dizer que veem por meio da química.
LE COUTEUR, R; BURRESON, J. Os botões de Napoleão: as 17 moléculas que mudaram a história. Rio de Janeiro: Jorge Zahar, 2006 (adaptado).
As moléculas dos sinalizadores químicos produzidas pelas abelhas rainha e operária possuem diferença na
A identificação de riscos de produtos perigosos para o transporte rodoviário é obrigatória e realizada por meio da sinalização composta por um painel de segurança, de cor alaranjada, e um rótulo de risco. As informações inseridas no painel de segurança e no rótulo de risco, conforme determina a legislação, permitem que se identifique o produto transportado e os perigos a ele associados.
A sinalização mostrada identifica uma substância que está sendo transportada em um caminhão.

Os três algarismos da parte superior do painel indicam o “Número de risco”. O número 268 indica tratar-se de um gás (2), tóxico (6) e corrosivo (8). Os quatro dígitos da parte inferior correspondem ao “Número ONU”, que identifica o produto transportado.
BRASIL. Resolução n. 420, de 12/02/2004, da Agência Nacional de Transportes Terrestres (ANTT)/Ministério dos Transportes (adaptado).
ABNT. NBR 7500: identificação para o transporte terrestre, manuseio, movimentação e armazenamento de produtos. Rio de Janeiro, 2004 (adaptado).
Considerando a identificação apresentada no caminhão,
o código 1005 corresponde à substância
Os combustíveis de origem fóssil, como o petróleo e o gás natural, geram um sério problema ambiental, devido à liberação de dióxido de carbono durante o processo de combustão. O quadro apresenta as massas molares e as reações de combustão não balanceadas de diferentes combustíveis.
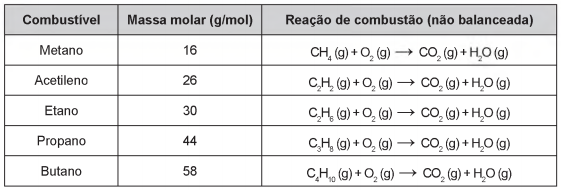
Considerando a combustão completa de 58 g de cada um dos combustíveis listados no quadro, a substância que emite
mais CO2 é o
O ácido acetilsalicílico, AAS (massa molar igual a 180 g/mol), é sintetizado a partir da reação do ácido salicílico (massa molar igual a 138 g/mol) com anidrido acético, usando-se ácido sulfúrico como catalisador, conforme a equação química:
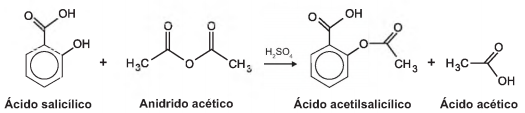
Após a síntese, o AAS é purificado e o rendimento flnal é de aproximadamente 50%. Devido às suas propriedades farmacológicas (antitérmico, analgésico, anti-inflamatório e antitrombótico), o AAS é utilizado como medicamento na forma de comprimidos, nos quais se emprega tipicamente uma massa de 500 mg dessa substância.
Uma indústria farmacêutica pretende fabricar um lote de 900 mil comprimidos, de acordo com as especificações do
texto. Qual é a massa de ácido salicílico, em kg, que deve ser empregada para esse fim?
Um bafômetro simples consiste em um tubo contendo uma mistura sólida de dicromato de potássio em sílica umedecida com ácido sulfúrico. Nesse teste, a detecção da embriaguez por consumo de álcool se dá visualmente, pois a reação que ocorre é a oxidação do álcool a aldeído e a redução do dicromato (alaranjado) a cromo(lll) (verde) ou cromo(ll) (azul).
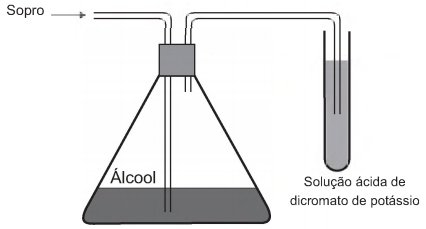
A equação balanceada da reação química que representa esse teste é:
Para cada litro de etanol produzido em uma indústria de cana-de-açúcar são gerados cerca de 18 L de vinhaça que é utilizada na irrigação das plantações de cana-de-açúcar, já que contém teores médios de nutrientes N, P e K iguais a 357 mg/L, 60 mg/L e 2 034 mg/L, respectivamente.
SILVA, M. A. S.; GRIEBELER, N. P; BORGES, L. C. Uso de vinhaça e impactos nas propriedades do solo e lençol freático. Revista Brasileira de Engenharia Agrícola e Ambiental, n. 1, 2007 (adaptado).
Na produção de 27 000 L de etanol, a quantidade total de fósforo, em kg, disponível na vinhaça será mais próxima de
Os calcários são materiais compostos por carbonato de cálcio, que podem atuar como solventes do dióxido de enxofre (SO2 ), um importante poluente atmosférico. As reações envolvidas no processo são a ativação do calcário, por meio de calcinação, e a fixação do SO2 com a formação de um sal de cálcio, como ilustrado pelas equações químicas simplificadas.
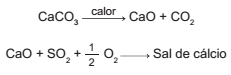
Considerando-se as reações envolvidas nesse processo
de dessulfurização, a fórmula química do sal de cálcio
corresponde a
O cobre presente nos fios elétricos e instrumentos musicais é obtido a partir da ustulação do minério calcosita (Cu2S). Durante esse processo, ocorre o aquecimento desse sulfeto na presença de oxigênio, de forma que o cobre fique "livre" e o enxofre se combine com o O2 produzindo SO2 , conforme a equação química:
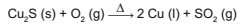
As massas molares dos elementos Cu e S são, respectivamente, iguais a 63,5 g/mol e 32 g/mol.
CANTO, E. L. Minerais, minérios, metais: de onde vêm?, para onde vão? São Paulo: Moderna, 1996 (adaptado).
Considerando que se queira obter 16 mols do metal em
uma reação cujo rendimento é de 80%, a massa, em
gramas, do minério necessária para obtenção do cobre
é igual a
O cobre, muito utilizado em fios da rede elétrica e com considerável valor de mercado, pode ser encontrado na natureza na forma de calcocita, Cu2S (s), de massa molar 159 g/mol. Por meio da reação Cu2S (s) + O2(g)  2 Cu (s) + S02 (g), é possível obtê-lo na forma metálica.
2 Cu (s) + S02 (g), é possível obtê-lo na forma metálica.
A quantidade de matéria de cobre metálico produzida a partir de uma tonelada de calcocita com 7,95% (m/m) de pureza é
CaCO3(s) + SO2 (g)
 CaS03(s) + CO2 (g) (1)
CaS03(s) + CO2 (g) (1)Por sua vez, o sulfito de cálcio formado pode ser oxidado, com o auxílio do ar atmosférico, para a obtenção do sulfato de cálcio, como mostrado na equação (2 ). Essa etapa é de grande interesse porque o produto da reação, popularmente conhecido como gesso, é utilizado para fins agrícolas.
2 CaSO3(s) + O2(g)
 2 CaS04(s) (2)
2 CaS04(s) (2)As massas molares dos elementos carbono, oxigênio, enxofre e cálcio são iguais a 12 g/mol, 16 g/mol, 32 g/mol e 40 g/mol, respectivamente.
BAIRD, C. Química ambiental. Porto Alegre: Bookman, 2002 (adaptado).
Considerando um rendimento de 90% no processo, a massa de gesso obtida, em gramas, por mol de gás retido é mais próxima de
LEE. J. D Química Inorgânica não tão concisa. São Paulo: Edgard Blucher. 1999 (adaptado).
Considerando que um forno foi alimentado com 2,5 toneladas de ferro-gusa, a massa de gás carbônico formada, em quilogramas, na produção de aço doce, é mais próxima de
Ácido muriático (ou ácido clorídrico comercial) é bastante utilizado na limpeza pesada de pisos para remoção de resíduos de cimento, por exemplo. Sua aplicação em resíduos contendo quantidades apreciáveis de CaCO3 resulta na liberação de um gás. Considerando a ampla utilização desse ácido por profissionais da área de limpeza, torna-se importante conhecer os produtos formados durante seu uso.
A fórmula do gás citado no texto e um teste que pode ser realizado para confirmar sua presença são, respectivamente:
Pesquisadores conseguiram produzir grafita magnética por um processo inédito em forno com atmosfera controlada e em temperaturas elevadas. No forno são colocados grafita comercial em pó e óxido metálico, tal como CuO. Nessas condições, o óxido é reduzido e ocorre a oxidação da grafita, com a introdução de pequenos defeitos, dando origem à propriedade magnética do material.
VASCONCELOS, Y. Um ímã diferente. Disponível em: http://revistapesquisa.fapesp.br. Acesso em: 24 fev. 2012 (adaptado).
Considerando o processo descrito com um rendimento de 100%, 8 g de CuO produzirão uma massa de CO2 igual a
Dados: Massa molar em g/mol: C = 12; O = 16; Cu = 64
Três amostras de minérios de ferro de regiões distintas foram analisadas e os resultados, com valores aproximados, estão na tabela:
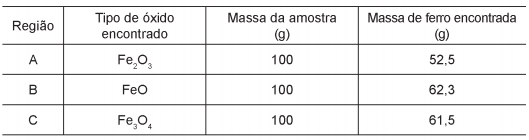
Considerando que as impurezas são inertes aos compostos envolvidos, as reações de redução do minério de ferro com carvão, de formas simplificadas, são:
2 Fe2O3 + 3 C → 4 Fe + 3 CO2
2 FeO + C → 2 Fe + CO2
Fe3O4 + 2 C → 3 Fe + 2 CO2
Dados: Massas molares (g/mol) C = 12; O = 16; Fe = 56; FeO = 72; Fe2O3 = 160; Fe3O4 = 232.
Os minérios que apresentam, respectivamente, a maior pureza e o menor consumo de carvão por tonelada de ferro
produzido são os das regiões:
Fator de emissão de CO2 = Massa de CO2 emitida/ Quantidade de material
O termo “quantidade de material” pode ser, por exemplo, a massa de material produzido em uma indústria ou a quantidade de gasolina consumida por um carro em um determinado período.
No caso da produção do cimento, o primeiro passo é a obtenção do óxido de cálcio, a partir do aquecimento do calcário a altas temperaturas, de acordo com a reação:
CaCO3(s) → CaO(s) + CO2(g)
Uma vez processada essa reação, outros compostos inorgânicos são adicionados ao óxido de cálcio, tendo o cimento formado 62% de CaO em sua composição.
Dados: Massas molares em g/mol — CO2 = 44; CaCO3 = 100; CaO = 56.
TREPTOW, R. S. Journal of Chemical Education. v. 87 n° 2, fev. 2010 (adaptado).
Considerando as informações apresentadas no texto, qual é, aproximadamente, o fator de emissão de CO2 quando 1 tonelada de cimento for produzida, levando-se em consideração apenas a etapa de obtenção do óxido de cálcio?