Questões do Enem Comentadas sobre química
Foram encontradas 460 questões
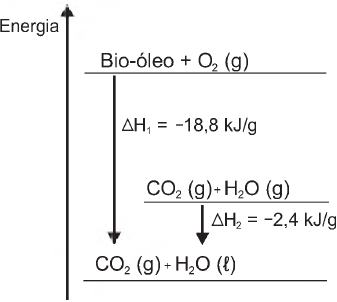
A variação de entalpia, em kJ, para a queima de 5 g desse bio-óleo resultando em CO2 (gasoso) e H2O (gasoso) é:

A equação química que representa a reação de formação da mancha avermelhada é:
A característica desses compostos, responsável pelo processo descrito no texto, é o(a)
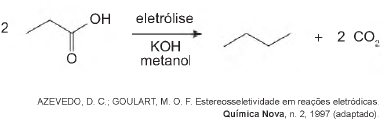
Com base nesse processo, o hidrocarboneto produzido na eletrólise do ácido 3,3-dimetil-butanoico é
2 ZnS + 3 O2 → 2 ZnO + 2 S02
ZnO + CO → Z n + C02
Considere as massas molares: ZnS (97 g/mol); O2 (32 g/mol);ZnO (81 g/mol); SO2 (64 g/mol); CO (28 g/mol); CO2 (44 g/mol); e Zn (65 g/mol).
Que valor mais próximo de massa de zinco metálico,em quilogramas, será produzido a partir de 100 kg de esfalerita?
ANDRADE, C. D. Poesia completa e prosa. Rio de Janeiro: Aguilar, 1973 (fragmento).
Nesse fragmento de poema, o autor refere-se à bomba atômica de urânio. Essa reação é dita “em cadeia" porque na
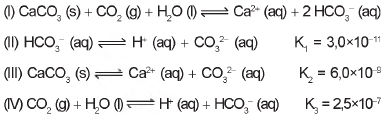
Com base nos valores das constantes de equilíbrio das reações II, III e IV a 25 “C, qual é o valor numérico da constante de equilíbrio da reação I?
MATEUS, A. L. Química na cabeça. Belo Horizonte: UFMG, 2001 (adaptado).
A explicação para o desaparecimento da cor rosa é que, com a combustão do palito de fósforo, ocorreu o(a)
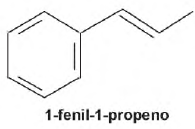
Os produtos obtidos na oxidação do alceno representado, em solução aquosa de KMnO4, são:
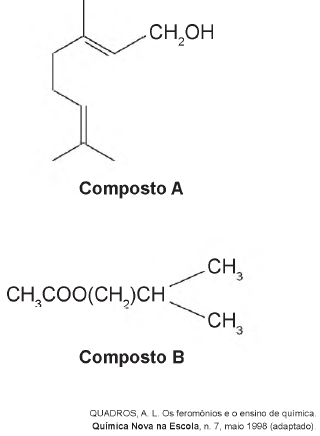
As funções orgânicas que caracterizam os feromônios de trilha e de alarme são, respectivamente,
SANTANA, V. M. S. A leitura e a química das substâncias. Cadernos PDE. Ivaiporã: Secretaria de Estado da Educação do Paraná (SEED); Universidade Estadual de Londrina, 2010 (adaptado).
Comprar uma lata de conserva amassada no supermercado é desaconselhável porque o amassado pode
MACHADO, R. Disponível em: www.correiobraziliense.com.br. Acesso em: 9 set. 2013 (adaptado).
No processo descrito, o excedente de energia elétrica é armazenado pela
Qual o valor mais próximo do volume da solução nutritiva, em litros, que o produtor deve adicionar ao tanque?
O fenômeno de “derretimento" decorre da
Um grupo de pesquisadores desenvolveu um método simples, barato e eficaz de remoção de petróleo contaminante na água, que utiliza um plástico produzido a partir do líquido da castanha-de-caju (LCC). A composição química do LCC é muito parecida com a do petróleo e suas moléculas, por suas características, interagem formando agregados com o petróleo. Para retirar os agregados da água, os pesquisadores misturam ao LCC nanopartículas magnéticas.
KIFFER, D. Novo método para remoção de petróleo usa óleo de mamona e castanha-de-caju.Disponível em: www.faperj.br. Acesso em: 31 jul. 2012 (adaptado).
Essa técnica considera dois processos de separação de misturas, sendo eles, respectivamente,

A alteração da concentração de hemoglobina oxigenada no sangue ocorre por causa do(a)
Fertilizantes químicos mistos, denominados NPK, são utilizados para aumentar a produtividade agrícola, por fornecerem os nutrientes nitrogênio, fósforo e potássio, necessários para o desenvolvimento das plantas. A quantidade de cada nutriente varia de acordo com a finalidade do adubo. Um determinado adubo NPK possui, em sua composição, as seguintes substâncias: nitrato de amônio (NH4NO3), ureia (CO(NH2)2) nitrato de potássio (KNO3), fosfato de sódio (Na3PO4) e 'cloreto de potássio (KCl).
A adição do adubo descrito provocou diminuição no pH de um solo. Considerando o caráter ácido/básico das substâncias constituintes desse adubo, a diminuição do pH do solo deve ser atribuída à presença, no adubo, de uma quantidade significativa de
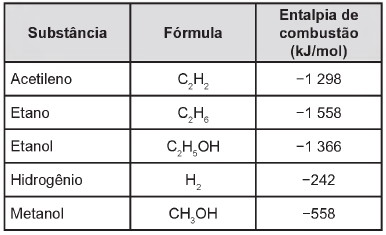
Levando-se em conta somente o aspecto energético, a substância mais eficiente para a obtenção de energia, na combustão de 1 kg de combustível, é o
A formação de estalactites depende da reversibilidade de uma reação química. O carbonato de cálcio (CaCO3) é encontrado em depósitos subterrâneos na forma de pedra calcária. Quando um volume de água rica em C 02 dissolvido infiltra-se no calcário, o minério dissolve-se formando íons Ca2+ e HCO3-. Numa segunda etapa, a solução aquosa desses íons chega a uma caverna e ocorre a reação inversa, promovendo a liberação de CO2 e a deposição de CaCO3, de acordo com a equação apresentada.
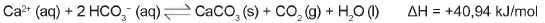
Considerando o equilíbrio que ocorre na segunda etapa, a formação de carbonato será favorecida pelo(a)
O cobre, muito utilizado em fios da rede elétrica e com considerável valor de mercado, pode ser encontrado na natureza na forma de calcocita, Cu2S (s), de massa molar 159 g/mol. Por meio da reação Cu2S (s) + O2(g)  2 Cu (s) + S02 (g), é possível obtê-lo na forma metálica.
2 Cu (s) + S02 (g), é possível obtê-lo na forma metálica.
A quantidade de matéria de cobre metálico produzida a partir de uma tonelada de calcocita com 7,95% (m/m) de pureza é