Questões do Enem
Sobre sistemas homogêneos: solubilidade dos sais, hidrólise dos sais e curvas de titulação. em química
Foram encontradas 11 questões
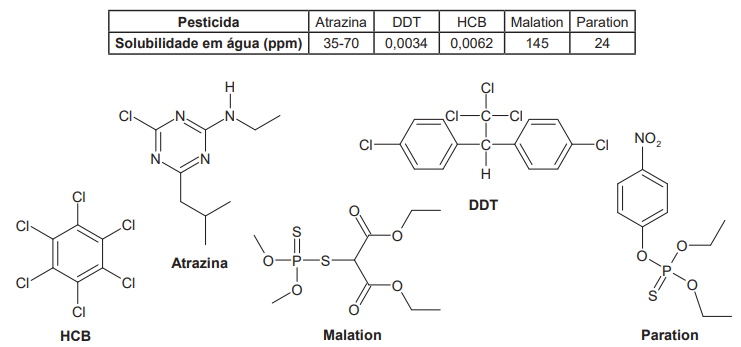
O pesticida transmitido a um lactente (bebê em amamentação) de dez meses, em maior proporção, é o:
Considere a massa molar da água igual a 18 g mol−1, e a massa molar do cloreto de cálcio anidro igual a 111 g mol−1.
Na hidratação da substância presente no antimofo, o ganho percentual, em massa, é mais próximo de
Os compostos contidos no calcário dolomítico elevam o pH do solo, pois
Diversos produtos naturais podem ser obtidos de plantas por processo de extração. O lapachol é da classe das naftoquinonas. Sua estrutura apresenta uma hidroxila enólica (pKa = 6,0) que permite que este composto seja isolado da serragem dos ipês por extração com solução adequada, seguida de filtração simples. Considere que pKa = -log Ka, em que Ka é a constante ácida da reação de ionização do lapachol.
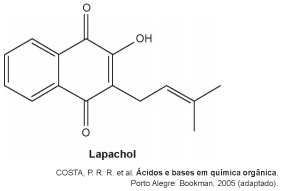
Qual solução deve ser usada para extração do lapachol
da serragem do ipê com maior eficiência?
Nos anos 1990, verificou-se que o rio Potomac, situado no estado norte-americano de Maryland, tinha, em parte de seu curso, águas extremamente ácidas por receber um efluente de uma mina de carvão desativada, o qual continha ácido sulfúrico (H2SO4). Essa água, embora límpida, era desprovida de vida. Alguns quilômetros adiante, instalou-se uma fábrica de papel e celulose que emprega hidróxido de sódio (NaOH) e carbonato de sódio (Na2CO3) em seus processos. Em pouco tempo, observou-se que, a partir do ponto em que a fábrica lança seus rejeitos no rio, a vida aquática voltou a florescer.
HARRIS, D. C. Análise química quantitativa. Rio de Janeiro: Livros Técnicos e Científicos, 2012 (adaptado).
A explicação para o retorno da vida aquática nesse rio é a
Os métodos empregados nas análises químicas são ferramentas importantes para se conhecer a composição dos diversos materiais presentes no meio ambiente. É comum, na análise de metais presentes em amostras ambientais, como água de rio ou de mar, a adição de um ácido mineral forte, normalmente o ácido nítrico (HNO3), com a finalidade de impedir a precipitação de compostos pouco solúveis desses metais ao longo do tempo.
Na ocorrência de precipitação, o resultado da análise pode ser subestimado, porque
Em meados de 2003, mais de 20 pessoas morreram no Brasil após terem ingerido uma suspensão de sulfato de bário utilizada como contraste em exames radiológicos. O sulfato de bário é um sólido pouquíssimo solúvel em água, que não se dissolve mesmo na presença de ácidos. As mortes ocorreram porque um laboratório farmacêutico forneceu o produto contaminado com carbonato de bário, que é solúvel em meio ácido. Um simples teste para verificar a existência de íons bário solúveis poderia ter evitado a tragédia. Esse teste consiste em tratar a amostra com solução aquosa de HCI e, após filtrar para separar os compostos insolúveis de bário, adiciona-se solução aquosa de H2SO4 sobre o filtrado e observa-se por 30 min.
TUBINO, M.; SIMONI, J. A. Refletindo sobre o caso Celobar®. Química Nova, n. 2, 2007 (adaptado).
A presença de íons bário solúveis na amostra é indicada pela
A água potável precisa ser límpida, ou seja, não deve conter partículas em suspensão, tais como terra ou restos de plantas, comuns nas águas de rios e lagoas. A remoção das partículas é feita em estações de tratamento, onde Ca(OH)2 em excesso e AI2(SO4)3 são adicionados em um tanque para formar sulfato de cálcio e hidróxido de alumínio. Esse último se forma como flocos gelatinosos insolúveis em água, que são capazes de agregar partículas em suspensão. Em uma estação de tratamento, cada 10 gramas de hidróxido de alumínio é capaz de carregar 2 gramas de partículas. Após decantação e filtração, a água límpida é tratada com cloro e distribuída para as residências. As massas molares dos elementos H, O, Al, S e Ca são, respectivamente, 1 g/mol, 16 g/mol, 27 g/mol, 32 g/mol e 40 g/mol.
Considerando que 1 000 litros da água de um rio possuem 45 gramas de partículas em suspensão, a quantidade mínima de AI2(SO4)3 que deve ser utilizada na estação de tratamento de água, capaz de tratar 3 000 litros de água de uma só vez, para garantir que todas as partículas em suspensão sejam precipitadas, é mais próxima de
Tabela 1: Solubilidade em água de alguns compostos presentes na água do mar a 25 oC
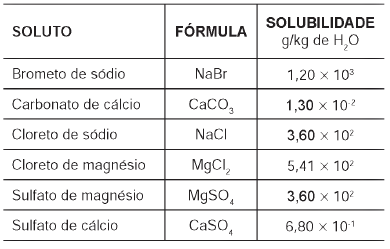
Pitombo, L.R.M.; Marcondes, M.E.R.; GEPEC. Grupo de pesquisa em Educação em Química. Química e Sobrevivência: Hidrosfera Fonte de Materiais. São Paulo: EDUSP, 2005 (adaptado).
Suponha que uma indústria objetiva separar determinados sais de uma amostra de água do mar a 25 °C, por meio da precipitação fracionada. Se essa amostra contiver somente os sais destacados na tabela, a seguinte ordem de precipitação será verificada:
Disponível em: http://www.odontologia.com.br. Acesso em: 27 jul. 2010 (adaptado).
A reação de dissolução da hidroxiapatita é:
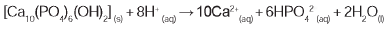
Dados: Massas molares em g/mol — [Ca10(PO4)6(OH2)] = 1004; HPO42 = 96; Ca = 40.
Supondo-se que o esmalte dentário seja constituído exclusivamente por hidroxiapatita, o ataque ácido que dissolve completamente 1 mg desse material ocasiona a formação de, aproximadamente,
