Questões do Enem
Comentadas sobre transformações: estados físicos e fenômenos em química
Foram encontradas 9 questões
A densidade é uma propriedade que relaciona massa e volume de um material. Um estudante iniciou um procedimento de determinação da densidade de uma amostra sólida desconhecida. Primeiro ele determinou a massa da amostra, obtendo 27,8 g. Em seguida, utilizou uma proveta, graduada em mililitro, com água para determinar o volume da amostra, conforme esquematizado na figura. Considere a densidade da água igual a 1 g/mL.
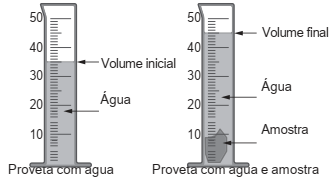
A densidade da amostra obtida, em g/mL, é mais
próxima de
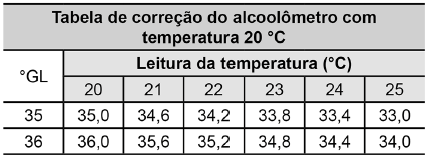 Manual alcoolômetro Gay Lussac. Disponível em: www.incoterm.com.br.
Acesso em: 4 dez. 2018 (adaptado).
Manual alcoolômetro Gay Lussac. Disponível em: www.incoterm.com.br.
Acesso em: 4 dez. 2018 (adaptado).
É necessária a correção da medida do instrumento, pois um aumento na temperatura promove o(a)
Para assegurar a boa qualidade de seu produto, uma indústria de vidro analisou um lote de óxido de silício (SiO2), principal componente do vidro. Para isso, submeteu uma amostra desse óxido ao aquecimento até sua completa fusão e ebulição, obtendo ao final um gráfico de temperatura T (°C) versus tempo t (min). Após a obtenção do gráfico, o analista concluiu que a amostra encontrava-se pura.
Dados do SiO2: Tfusão = 1 600 °C; Tebulição = 2 230 °C.
Qual foi o gráfico obtido pelo analista?
O quadro apresenta alguns exemplos de combustíveis empregados em residências, indústrias e meios de transporte.
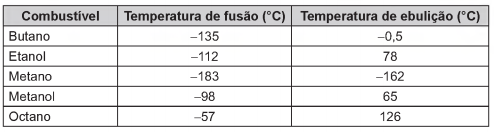
São combustíveis líquidos à temperatura ambiente de 25 ºC:
A bauxita, composta por cerca de 50% de Al2O3, é o mais importante minério de alumínio. As seguintes etapas são necessárias para a obtenção de alumínio metálico:
1. A dissolução do AI2O3 (s) é realizada em solução de NaOH (aq) a 175 “C, levando à formação da espécie solúvel NaAI(OH)4 (aq).
2. Com o resfriamento da parte solúvel, ocorre a precipitação do AI(OH)3 (s).
3. Quando o AI(OH)3 (s) é aquecido a 1 050 “C, ele se decompõe em Al2O3 (s) e H2O.
4. Al2O3 (s) é transferido para uma cuba eletrolítica e fundido em alta temperatura com auxílio de um fundente.
5. Através da passagem de corrente elétrica entre os eletrodos da cuba eletrolítica, obtém-se o alumínio reduzido no cátodo.
As etapas 1, 3 e 5 referem-se, respectivamente,
a fenômenos:
Primeiro, em relação àquilo a que chamamos água, quando congela, parece-nos estar a olhar para algo que se tornou pedra ou terra, mas quando derrete e se dispersa, esta torna-se bafo e ar; o ar, quando é queimado, torna-se fogo; e, inversamente, o fogo, quando se contrai e se extingue, regressa à forma do ar; o ar, novamente concentrado e contraído, torna-se nuvem e nevoeiro, mas, a partir destes estados, se for ainda mais comprimido, torna-se água corrente, e de água torna-se novamente terra e pedras; e deste modo, como nos parece, dão geração uns aos outros de forma cíclica.
PLATÃO. Timeu-Crítias. Coimbra: CECH, 2011.
Do ponto de vista da ciência moderna, os “quatro elementos” descritos por Platão correspondem, na verdade, às fases sólida, líquida, gasosa e plasma da matéria. As transições entre elas são hoje entendidas como consequências macroscópicas de transformações sofridas pela matéria em escala microscópica.
MATEUS, A. L. Química na cabeça. Belo Horizonte: UFMG, 2001 (adaptado).
A explicação para o desaparecimento da cor rosa é que, com a combustão do palito de fósforo, ocorreu o(a)
MACHADO, R. Disponível em: www.correiobraziliense.com.br. Acesso em: 9 set. 2013 (adaptado).
No processo descrito, o excedente de energia elétrica é armazenado pela
• Colocou uma caneca metálica contendo água no fogareiro do fogão de sua casa.
• Quando a água começou a ferver, encostou cuidadosamente a extremidade mais estreita de uma seringa de injeção, desprovida de agulha, na superfície do líquido e, erguendo o êmbolo da seringa, aspirou certa quantidade de água para seu interior, tapando-a em seguida.
• Verificando após alguns instantes que a água da seringa havia parado de ferver, ele ergueu o êmbolo da seringa, constatando, intrigado, que a água voltou a ferver após um pequeno deslocamento do êmbolo.
Considerando o procedimento anterior, a água volta a ferver porque esse deslocamento