Questões do ENEM 2014 para Exame Nacional do Ensino Médio - Primeiro e Segundo Dia
Foram encontradas 18 questões
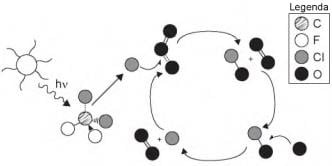
Quimicamente, a destruição do ozônio na atmosfera por gases CFCs é decorrência da
Essa fonte de energia subutilizada, citada no texto, é o
SPIRO, T. G.; STIGLIANI, W. M. Química ambiental. São Paulo: Pearson, 2009 (adaptado).
Visando eliminar da água o clorofórmio e outras moléculas orgânicas, o tratamento adequado é a
COELHO, F. A. S. Fármacos e quiralidade. Cadernos Temáticos de Química Nova na Escola, São Paulo, n. 3, maio 2001 (adaptado).
Essa malformação congênita ocorre porque esses enantiômeros
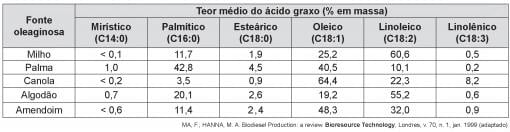
Qual das fontes oleaginosas apresentadas produziria um biodiesel de maior resistência à oxidação?
Os impactos da má qualidade do óleo diesel brasileiro. Disponível em: www.cnt.org.br.Acesso em: 20 dez. 2012 (adaptado).
A substituição do diesel usado nos anos 1980 por aquele difundido em 2012 permitiu uma redução percentual de emissão de SO3 de
SANTOS, W. L. P.; MÓL, G. S. (Coords.). Química e sociedade. São Paulo: Nova Geração, 2005 (adaptado).
A substância capaz de formar as estruturas mencionadas é

Das espécies apresentadas, a adequada para essa recuperação é
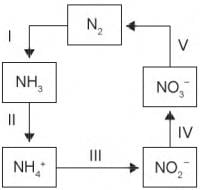
O processo citado está representado na etapa
O grupo responsável pela bioatividade desse fármaco é
Que parte do ciclo de geração de energia das usinas nucleares está associada a esse tipo de poluição?
Para que o resíduo possa ser lançado diretamente no corpo receptor, qual substância poderia ser empregada no ajuste do pH?
O tubo de ensaio em que a enzima deve agir para indicar que a hipótese do pesquisador está correta é aquele que contém
A fórmula que se enquadra nas características da molécula investigada é
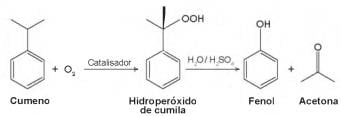
Considerando as características físico-químicas dos dois insumos formados, o método utilizado para a separação da mistura, em escala industrial, é a
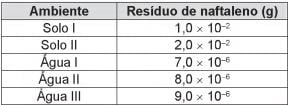
O ambiente que necessita de biorremediação é o(a)
SILVA, V. A.;BENITE, A.M.C.; SOARES , M. H.F.B. Algo aqui não cheira bem... A química do mau cheiro. Química Nova na Escola , v. 33, n.1, fev. 2011 (adaptado).
A eficiência do uso do vinagre nesse caso se explica pela
CaCO3(s) + SO2 (g)
 CaS03(s) + CO2 (g) (1)
CaS03(s) + CO2 (g) (1)Por sua vez, o sulfito de cálcio formado pode ser oxidado, com o auxílio do ar atmosférico, para a obtenção do sulfato de cálcio, como mostrado na equação (2 ). Essa etapa é de grande interesse porque o produto da reação, popularmente conhecido como gesso, é utilizado para fins agrícolas.
2 CaSO3(s) + O2(g)
 2 CaS04(s) (2)
2 CaS04(s) (2)As massas molares dos elementos carbono, oxigênio, enxofre e cálcio são iguais a 12 g/mol, 16 g/mol, 32 g/mol e 40 g/mol, respectivamente.
BAIRD, C. Química ambiental. Porto Alegre: Bookman, 2002 (adaptado).
Considerando um rendimento de 90% no processo, a massa de gesso obtida, em gramas, por mol de gás retido é mais próxima de