Questões do ENEM 2014 para Exame Nacional do Ensino Médio - Primeiro e Segundo Dia
Foram encontradas 180 questões
SILVA, V. A.;BENITE, A.M.C.; SOARES , M. H.F.B. Algo aqui não cheira bem... A química do mau cheiro. Química Nova na Escola , v. 33, n.1, fev. 2011 (adaptado).
A eficiência do uso do vinagre nesse caso se explica pela
O ouvido absoluto é uma característica perceptual de poucos indivíduos capazes de identificar notas isoladas sem outras referências, isto é, sem precisar relacioná-las com outras notas de uma melodia.
LENT, R. O cérebro do meu professor de acordeão. Disponível em: http://cienciahoje.uol.com.br Acesso em: 15 ago. 2012 (adaptado).
No contexto apresentado, a propriedade física das ondas que permite essa distinção entre as notas é a
CaCO3(s) + SO2 (g)
 CaS03(s) + CO2 (g) (1)
CaS03(s) + CO2 (g) (1)Por sua vez, o sulfito de cálcio formado pode ser oxidado, com o auxílio do ar atmosférico, para a obtenção do sulfato de cálcio, como mostrado na equação (2 ). Essa etapa é de grande interesse porque o produto da reação, popularmente conhecido como gesso, é utilizado para fins agrícolas.
2 CaSO3(s) + O2(g)
 2 CaS04(s) (2)
2 CaS04(s) (2)As massas molares dos elementos carbono, oxigênio, enxofre e cálcio são iguais a 12 g/mol, 16 g/mol, 32 g/mol e 40 g/mol, respectivamente.
BAIRD, C. Química ambiental. Porto Alegre: Bookman, 2002 (adaptado).
Considerando um rendimento de 90% no processo, a massa de gesso obtida, em gramas, por mol de gás retido é mais próxima de
O poder terapêutico dessas células baseia-se em sua capacidade de
Durante um teste de controle para o desenvolvimento de novas lentes fotocromáticas, foram analisadas cinco amostras, que utilizam reagentes químicos diferentes. No quadro, são apresentados os resultados.
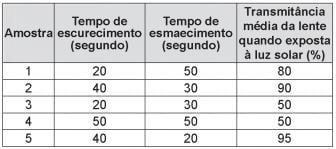
Considerando os três aspectos, qual é a melhor amostra de lente fotocromática para se utilizar em óculos?