Questões do ENEM 2016 para Exame Nacional do Ensino Médio - Primeiro e Segundo Dia (2ª Aplicação)
Foram encontradas 14 questões
Os métodos empregados nas análises químicas são ferramentas importantes para se conhecer a composição dos diversos materiais presentes no meio ambiente. É comum, na análise de metais presentes em amostras ambientais, como água de rio ou de mar, a adição de um ácido mineral forte, normalmente o ácido nítrico (HNO3), com a finalidade de impedir a precipitação de compostos pouco solúveis desses metais ao longo do tempo.
Na ocorrência de precipitação, o resultado da análise pode ser subestimado, porque
Algumas práticas agrícolas fazem uso de queimadas, apesar de produzirem grandes efeitos negativos. Por exemplo, quando ocorre a queima da palha de cana-de-açúcar, utilizada na produção de etanol, há emissão de poluentes como CO2, SOx, NOx e materiais particulados (MP) para a atmosfera. Assim, a produção de biocombustíveis pode, muitas vezes, ser acompanhada da emissão de vários poluentes.
CARDOSO, A. A.; MACHADO, C. M. D.; PEREIRA, E. A. Biocombustível: o mito do combustível limpo. Química Nova na Escola, n. 28, maio 2008 (adaptado).
Considerando a obtenção e o consumo desse biocombustível, há transformação química quando
O soro fisiológico é uma solução aquosa de cloreto de sódio (NaCl) comumente utilizada para higienização ocular, nasal, de ferimentos e de lentes de contato. Sua concentração é 0,90% em massa e densidade igual a 1,00 g/mL.
Qual massa de NaCl, em grama, deverá ser adicionada à água para preparar 500 mL desse soro?
Os gráficos representam a concentração na atmosfera, em partes por milhão (ppm), bilhão (ppb) ou trilhão (ppt), dos cinco gases responsáveis por 97% do efeito estufa durante o período de 1978 a 2010.
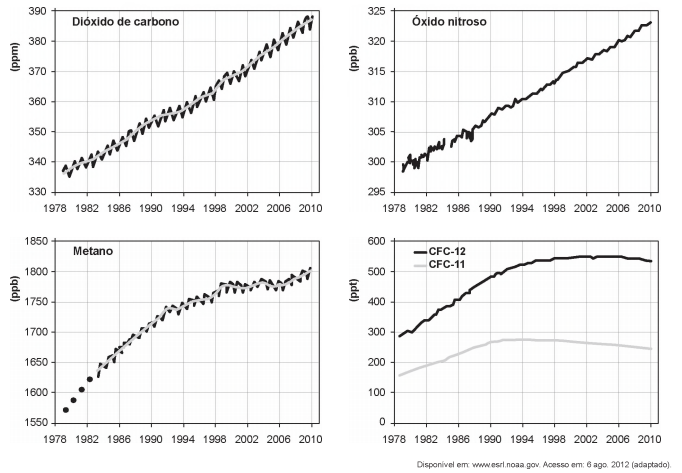
Qual gás teve o maior aumento percentual de concentração na atmosfera nas últimas duas décadas?
Nos anos 1990, verificou-se que o rio Potomac, situado no estado norte-americano de Maryland, tinha, em parte de seu curso, águas extremamente ácidas por receber um efluente de uma mina de carvão desativada, o qual continha ácido sulfúrico (H2SO4). Essa água, embora límpida, era desprovida de vida. Alguns quilômetros adiante, instalou-se uma fábrica de papel e celulose que emprega hidróxido de sódio (NaOH) e carbonato de sódio (Na2CO3) em seus processos. Em pouco tempo, observou-se que, a partir do ponto em que a fábrica lança seus rejeitos no rio, a vida aquática voltou a florescer.
HARRIS, D. C. Análise química quantitativa. Rio de Janeiro: Livros Técnicos e Científicos, 2012 (adaptado).
A explicação para o retorno da vida aquática nesse rio é a
Utensílios de uso cotidiano e ferramentas que contêm ferro em sua liga metálica tendem a sofrer processo corrosivo e enferrujar. A corrosão é um processo eletroquímico e, no caso do ferro, ocorre a precipitação do óxido de ferro(III) hidratado, substância marrom pouco solúvel, conhecida como ferrugem. Esse processo corrosivo é, de maneira geral, representado pela equação química:
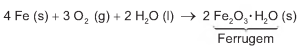
Uma forma de impedir o processo corrosivo nesses
utensílios é
Em Bangladesh, mais da metade dos poços artesianos cuja água serve à população local está contaminada com arsênio proveniente de minerais naturais e de pesticidas. O arsênio apresenta efeitos tóxicos cumulativos. A ONU desenvolveu um kit para tratamento dessa água a fim de torná-la segura para o consumo humano. O princípio desse kit é a remoção do arsênio por meio de uma reação de precipitação com sais de ferro(III) que origina um sólido volumoso de textura gelatinosa.
Disponível em: http://tc.iaea.org. Acesso em: 11 dez. 2012 (adaptado).
Com o uso desse kit, a população local pode remover o elemento tóxico por meio de
A obtenção do alumínio dá-se a partir da bauxita (Al2O3 .3H2O), que é purificada e eletrolisada numa temperatura de 1 000 °C. Na célula eletrolítica, o ânodo é formado por barras de grafita ou carvão, que são consumidas no processo de eletrólise, com formação de gás carbônico, e o cátodo é uma caixa de aço coberta de grafita.
A etapa de obtenção do alumínio ocorre no
O petróleo é um tipo de combustível fóssil, de origem animal e vegetal, constituído principalmente por hidrocarbonetos. Em desastres de derramamento de petróleo, vários métodos são usados para a limpeza das áreas afetadas. Um deles é a biodegradação por populações naturais de microrganismos que utilizam o petróleo como fonte de nutrientes. O quadro mostra a composição química média das células desses microrganismos.
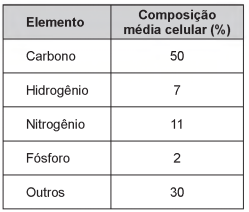
Para uma efetiva biodegradação, a região afetada deve
ser suplementada com
O principal componente do sal de cozinha é o cloreto de sódio, mas o produto pode ter aluminossilicato de sódio em pequenas concentrações. Esse sal, que é insolúvel em água, age como antiumectante, evitando que o sal de cozinha tenha um aspecto empedrado.
O procedimento de laboratório adequado para verificar a presença do antiumectante em uma amostra de sal de cozinha é o(a)
O ambiente marinho pode ser contaminado com rejeitos radioativos provenientes de testes com armas nucleares. Os materiais radioativos podem se acumular nos organismos. Por exemplo, o estrôncio-90 é quimicamente semelhante ao cálcio e pode substituir esse elemento nos processos biológicos.
FIGUEIRA, R. C. L.; CUNHA, I. I. L. A contaminação dos oceanos por radionuclídeos antropogênicos. Química Nova na Escola, n. 1, 1998 (adaptado).
Um pesquisador analisou as seguintes amostras coletadas em uma região marinha próxima a um local que manipula o estrôncio radioativo: coluna vertebral de tartarugas, concha de moluscos, endoesqueleto de ouriços-do-mar, sedimento de recife de corais e tentáculos de polvo.
Em qual das amostras analisadas a radioatividade foi
menor?
A bauxita é o minério utilizado na fabricação do alumínio, a qual apresenta Al2O3 (alumina) em sua composição. Após o trituramento e lavagem para reduzir o teor de impurezas, o minério é misturado a uma solução aquosa de NaOH (etapa A). A parte sólida dessa mistura é rejeitada e a solução resultante recebe pequenos cristais de alumina, de onde sedimenta um sólido (etapa B). Esse sólido é aquecido até a obtenção de um pó branco, isento de água e constituído unicamente por alumina. Finalmente, esse pó é aquecido até sua fusão e submetido a uma eletrólise, cujos produtos são o metal puro fundido (Al) e o gás carbônico (CO2).
SILVA FILHO, E. B.; ALVES, M. C. M.; DA MOTTA, M. Lama vermelha da indústria de beneficiamento de alumina: produção, características, disposição e aplicações alternativas. Revista Matéria, n. 2, 2007.
Nesse processo, as funções das etapas A e B são, respectivamente,
A energia nuclear é uma alternativa aos combustíveis fósseis que, se não gerenciada de forma correta, pode causar impactos ambientais graves. O princípio da geração dessa energia pode se basear na reação de fissão controlada do urânio por bombardeio de nêutrons, como ilustrado:
235U + n → 95Sr + 139Xe + 2 n + energia
Um grande risco decorre da geração do chamado lixo atômico, que exige condições muito rígidas de tratamento e armazenamento para evitar vazamentos para o meio ambiente.
Esse lixo é prejudicial, pois
Para lavar e refrescar o ambiente, que estava a 40 °C, uma pessoa resolveu jogar água sobre um piso de granito. Ela observou que o líquido se concentrou em algumas regiões, molhando parcialmente a superfície. Ao adicionar detergente sobre essa água, a pessoa verificou que o líquido se espalhou e deixou o piso totalmente molhado.
A molhabilidade da superfície foi melhorada em função da