Questões Militares
Comentadas sobre 1ª lei da termodinâmica em física
Foram encontradas 24 questões
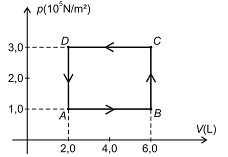
Dois mols de um gás perfeito passam pelo ciclo mostrado no diagrama da pressão versus volume da figura. A temperatura medida no estado A é 200 K, a constante universal dos gases perfeitos é R = 8,32 J.mol / K e o calor molar a volume constante é Cv = 5R/2.
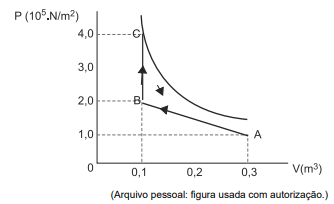
Considerando os dados apresentados na figura e no enunciado, assinale a alternativa que apresenta corretamente o valor do trabalho total w realizado pelo gás ao longo de todo o ciclo ABCDA.
Assinale a alternativa que indica corretamente a relação entre os valores, em módulo, das quantidades de calores QA, QB, e QC envolvidos, respectivamente, nos caminhos A, B e C.
FÍSICA
Nas questões de Física, quando necessário, utilize:
• aceleração da gravidade: g = 10 m/s2
• cos 30º = sen 60º = √3 /2
• cos 60º = sen 30º = 1 2
• calor específico da água: c = 1 cal/(g·ºC)
• calor latente de fusão do gelo: Lf = 80 cal/g
• temperatura de fusão do gelo: θf = 0 ºC
• densidade do gelo: µg = 0,92 g/cm3
• densidade da água: µA = 1,0 g/cm3
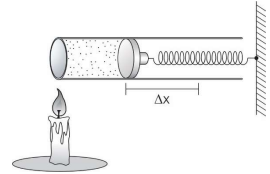
Em outro momento, para as mesmas condições iniciais anteriores, ao se fornecer o dobro da quantidade de calor 2Q, a esse sistema, observa-se que a mola sofre uma deformação duas vezes maior, 2∆x.
Considerando que nas duas expansões o sistema tenha sofrido a mesma variação de energia interna e que não houve atrito entre o pistão e o cilindro, pode-se afirmar que a constante elástica da mola vale
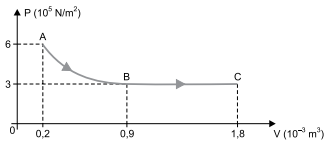
Para produzir essa transformação, 1000 J de energia em forma de calor foram fornecidos a esse sistema, dos quais 360 J transformaram-se em energia interna do gás. Desprezando todas as perdas de energia, o trabalho realizado pelas forças exercidas pelo gás na transformação AB foi de
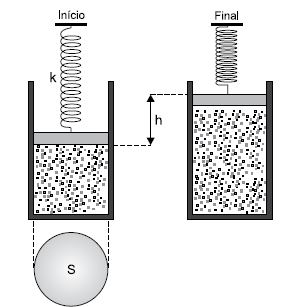
Desprezando todos os atritos e considerando 1 atm = 105 Pa, o deslocamento vertical h sofrido pelo pistão até atingir a posição final é de, aproximadamente,
É comum, na Termodinâmica, utilizar a seguinte expressão: (P1V1)/T1 é igual a (P2V2)/T2. Nessa expressão, P, V e T representam, respectivamente, a pressão, o volume e a temperatura de uma amostra de um gás ideal. Os números representam os estados inicial (1) e final (2). Para utilizar corretamente essa expressão é necessário que o número de mols, ou de partículas, do estado final seja _________ do estado inicial e que a composição dessa amostra seja _________ nos estados final e inicial.
Assinale a alternativa que completa corretamente as lacunas da
frase acima.
Na questão de Física, quando necessário, use:
• Aceleração da gravidade: g = 10 m/s2 ;
• sen 19° = cos 71° = 0,3;
• sen 71°= cos 19° = 0,9;
• Velocidade da luz no vácuo: c = 3,0 ⋅ 10 m/s 8 ;
• Constante de Planck: h = 6,6 ⋅10-34 J.s;
• 1eV = 1,6 ⋅10-19 J;
• Potencial elétrico no infinito: zero.
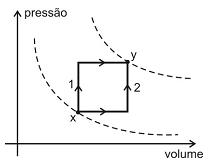
Um sistema gasoso constituído por n mols de um gás perfeito passa do estado x para o estado y por meio dos processos distintos 1 e 2 mostrados no esquema a seguir.
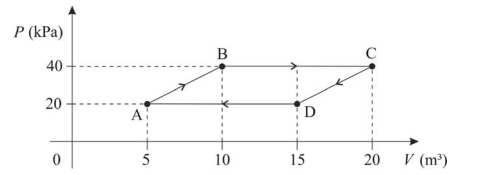
O gráfico a seguir representa uma transformação cíclica sofrida por uma determinada massa de gás perfeito.
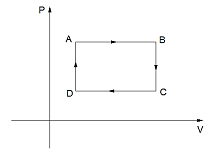
No ciclo ABCDA em questão tem-se que:
Na questão de Física, quando necessário, use aceleração da gravidade: g = 10 m/s2
sen30° = 1/2;
cos30° = 
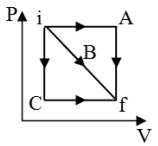
Um sistema termodinâmico constituído de n mols de um gás perfeito monoatômico desenvolve uma transformação cíclica ABCDA representada no diagrama a seguir.
De acordo com o apresentado pode-se afirmar que
Nas questões de Física, quando necessário, use aceleração da gravidade: g = 10 m/s2
densidade da água: d = 1,0 kg/L
calor específico da água: c = 1 cal/g °C
1 cal = 4 J
constante eletrostática: k = 9,0.109 N.m2 /C2
constante universal dos gases perfeitos: R = 8 J/mol.K
Um cilindro adiabático vertical foi dividido em duas partes por um êmbolo de 6,0 kg de massa que pode deslizar sem atrito. Na parte superior, fez-se vácuo e na inferior foram colocados 2 mols de um gás ideal monoatômico. Um resistor de resistência elétrica ôhmica R igual a 1 Ω é colocado no interior do gás e ligado a um gerador elétrico que fornece uma corrente elétrica i, constante, de 400 mA, conforme ilustrado na figura abaixo.
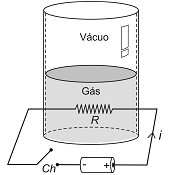
Fechando-se a chave Ch durante 12,5 min, o êmbolo
desloca-se 80 cm numa expansão isobárica de um estado de
equilíbrio para outro. Nessas condições, a variação da
temperatura do gás foi, em °C, de
Dados: calor específico do cobre: 0,39 kJ/kg°C; calor específico da água: 4,18 kJ/kg°C.
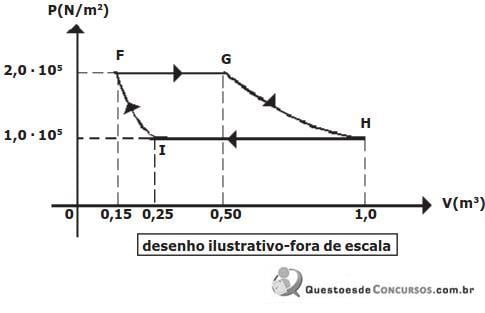
A variação de energia interna sofrida pelo gás na transformação adiabática IF é
eletromagnetismo.
