Questões Militares
Sobre cinética química em química
Foram encontradas 79 questões
A água oxigenada ou solução aquosa de peróxido de hidrogênio ( H2O2) é uma espécie bastante utilizada no dia a dia na desinfecção de lentes de contato e ferimentos. A sua decomposição produz oxigênio gasoso e pode ser acelerada por alguns fatores como o incremento da temperatura e a adição de catalisadores. Um estudo experimental da cinética da reação de decomposição da água oxigenada foi realizado alterando-se fatores como a temperatura e o emprego de catalisadores, seguindo as condições experimentais listadas na tabela a seguir:

O etino, também conhecido como acetileno, é um alcino muito importante na Química. Esse composto possui várias aplicações, dentre elas o uso como gás de maçarico oxiacetilênico, cuja chama azul atinge temperaturas em torno de 3000 °C.
A produção industrial do gás etino está representada, abaixo, em três etapas, conforme as equações balanceadas:

Considerando as etapas citadas e admitindo que o rendimento de cada etapa da obtenção do
gás etino por esse método é de 100 %, então a massa de carbonato de cálcio (CaCO3(s)) necessária para produzir 5,2 g do gás etino (C2H2(g)) é
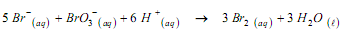
Sabendo que a velocidade de desaparecimento do íon bromato é igual a 5,63×10− 6 mol. L−1. s −1, assinale a alternativa que apresenta o valor CORRETO para a velocidade de aparecimento do bromo,Br2, expressa em mol . L−1.s −1⋅
CaCO3 ? CaO + CO2
Certa massa de carbonato de cálcio foi aquecida e o volume de gás carbônico desprendido foi medido em função do tempo, conforme a tabela abaixo
Mols de CO2 Tempo (segundos)
0-------------------------- 0
2,25---------------------120
2,00---------------------240
1,50---------------------360
0,12---------------------720
No intervalo entre 4 a 6 minutos a velocidade média da reação, em mols.min-1
Analise a tabela a seguir, e assinale a opção que completa corretamente as lacunas da sentença abaixo.
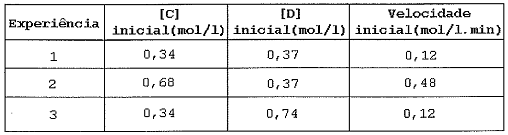
Dada a reação: C + 2D → produtos, foram efetuadas 3 experiências e montada a tabela acima.
Analisando as experiências, é correto afirmar que a velocidade de reação é de ___________ em relação a _________ .
Considere que a reação hipotética representada pela equação química X+Y → Z ocorra em três condições diferentes (a, b e c), na mesma temperatura, pressão e composição total (número de moléculas de X+Y), a saber:
a- O número de moléculas de X é igual ao número de moléculas de Y.
b- O número de moléculas de X é 1/3 do número de moléculas de Y.
c- O número de moléculas de Y é 1/3 do número de moléculas de X.
Baseando nestas informações, considere que sejam feitas as seguintes afirmações:
I. Se a lei de velocidade da reação for v = k [X].[Y]2, então vc < va < vb
II. Se a lei de velocidade da reação for v = k [X].[Y] , então vb = vc < va
III. Se a lei de velocidade da reação for v = k [X] , então t1/2(c) > t1/2(b) > t1/2(a)
Das afirmações acima, está(ão) CORRETA(S) apenas
t (s) C1 ( mol/L) C2 ( mol/L) C3 ( mol/L)
200 0,8000 0,8333 0,8186
210 0,7900 0,8264 0,8105
220 0,7800 0,8196 0,8024
230 0,7700 0,8130 0,7945
240 0,7600 0,8064 0,7866
Considere que o modelo ∆c ⁄∆t = − KCn descreva adequadamente as velocidades das reações estudadas. Considere ainda que as magnitudes das constantes de velocidade específica de todas as reações são idênticas à da reação de segunda ordem, que é 1,0 x10-3 L/mol.s. Assim, pode-se afirmar que C1, C2 e C3 referem-se, respectivamente, a reações de ordem
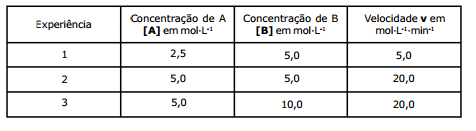
Baseando-se na tabela, são feitas as seguintes afirmações:
I- A reação é elementar.
II- A expressão da velocidade da reação é v=K·[A] 3·[B]2.
III- A expressão da velocidade da reação é v=K·[A] 2.[B]0.
IV- Dobrando-se a concentração de B, o valor da velocidade da reação não se altera.
V- A ordem da reação em relação a B é 1 (1ª ordem).
Das afirmações feitas, utilizando os dados acima, estão corretas apenas
A figura mostra o perfil reacional da decomposição de um composto X por dois caminhos reacionais diferentes, I e II .
Baseado nas informações apresentadas nessa figura, assinale a opção ERRADA.
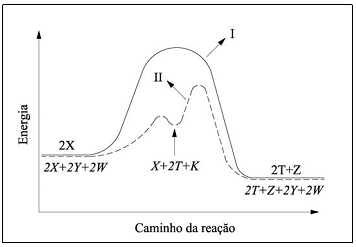
Da analise dos gráficos, é correto afirmar que:
I. À distância de 0,074 nm a energia cinética é máxima.
II. Quando a distância entre esses dois átomos é 0,074 nm a energia potencial é mínima.
III. A energia necessária para romper um mol de ligações de H2 é 458 kJ.
IV. A distância de 0,074 nm é o comprimento da ligação no H2

Admita a variação de concentração em mol por litro (mol·L-1) do monóxido de nitrogênio (NO) em função do tempo em segundos (s), conforme os dados, da tabela abaixo:
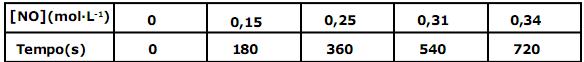
A velocidade média, em função do monóxido de nitrogênio (NO), e a velocidade média da reação acima representada, no intervalo de tempo de 6 a 9 minutos (min), são, respectivamente, em mol·L-1·min-1:
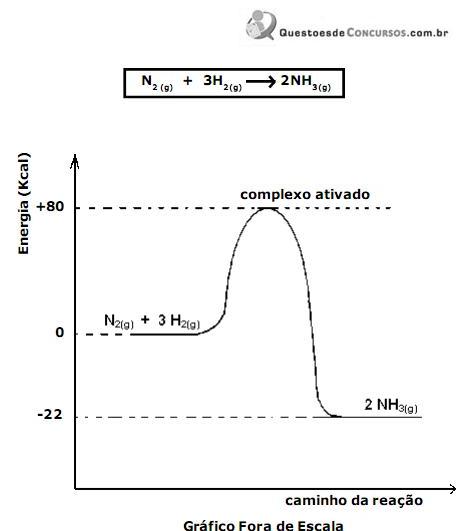
Relativo ao gráfico envolvendo essa reação e suas informações, são feitas as seguintes afirmações:
I - O valor da energia envolvida por um mol de NH3 formado é 22 kcal.
II - O valor da energia de ativação dessa reação é 80 kcal.
III - O processo que envolve a reação N2(g) + 3H2(g) → 2NH3(g) é endotérmico.
Das afirmações feitas, está(ão) correta(s)
Considere o seguinte mecanismo de reação genérica:
A4++ B2+ → A3+ + B3+ (etapa lenta)
A4+ + B3+ → A3+ + B4+ (etapa rápida)
C+ + B4+ → C3+ + B2+ (etapa rápida)
Com relação a este mecanismo, assinale a opção ERRADA.
Considere a sequência de reações associadas ao processo de oxidação do dióxido de enxofre

O carbonato de sódio (Na2CO3) empregado na fabricação de vidro é preparado a partir do carbonato de cálcio (CaCO3) e cloreto de sódio (NaCl), segundo a equação balanceada:
CaCO3 + 2 NaCl → Na2CO3 + CaCl2
Partindo-se de 1250 g de carbonato de cálcio (com grau de pureza de 80%) e 650 g de cloreto de sódio (com grau de pureza de 90%), a massa de carbonato de sódio (Na2CO3) obtida dessa reação, admitindo-se um rendimento da reação de 80%, será de:
Dados:
Massas atômicas: C=12u; O=16u; Na=23u; Cl=35,5u; Ca=40u
A tabela abaixo indica valores das velocidades da reação (v) em três experimentos e as correspondentes concentrações em mol/L dos reagentes X e Y em idênticas condições.

O processo químico é representado pela equação abaixo, na qual a, b e c representam seus coeficientes.
a X + b y → c Z
A equação da velocidade desse processo é: